Sterk elektrolytconcept, kenmerken, voorbeelden

- 3806
- 229
- Dr. Rickey Hudson
A Sterke elektrolyt Het is al die stof die opgelost is in water, of in een specifiek oplosmiddel, volledig is gedissocieerd op ionen. Daarom zou er geen oplossing moeten zijn als neutrale moleculen, of als onoplosbare vaste stoffen. Een sterke elektrolyt kan een zout, een zuur of een basis zijn, op voorwaarde dat ze dissociëren of volledig ionisch zijn.
Het meest representatieve voorbeeld van een elektrolyt is gewoon zout, natriumchloride, NaCl. In waterige oplossing dissociëren NaCl -kristallen in hun geheel om na ionen te produceren+ en Cl-, die uiteindelijk watermoleculen omringen. Er wordt dan gezegd dat een zout zich gedraagt als een sterke elektrolyt wanneer de oplosbaarheid ervan erg hoog in water is.
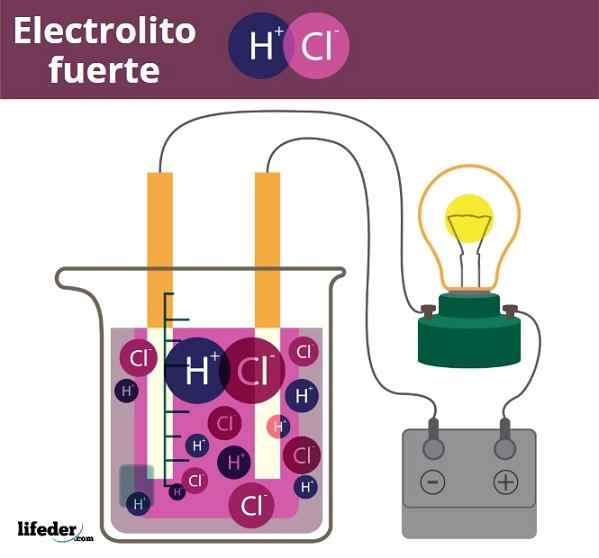 Fuero Electrolite voorbeeld. HCL, zoutzuur, afgifte H3O+ en Cl ionen-
Fuero Electrolite voorbeeld. HCL, zoutzuur, afgifte H3O+ en Cl ionen- Enigszins vergelijkbaar is het geval van zuren en basen. Wanneer deze sterk zijn, produceren hun oplossingen in water de maximaal mogelijke hoeveelheid H -ionen3OF+ of oh-, PH -veranderingen zijn dus abrupt. Voorbeelden van sterke zuren en basen zijn salpeterzuur, HNO3, en respectievelijk kaliumhydroxide, KOH, respectievelijk.
Het is belangrijk om te weten hoe je sterke elektrolyten kunt identificeren bij het bereiden van zeer ionische oplossingen, of zeer sterk zuur of basismiddelen.
[TOC]
Kenmerken van sterke elektrolyten
Oplosbaarheid
Sterke elektrolyten worden gekenmerkt door extreem oplosbare waterstoffen te zijn. Of vast of gassen, wanneer het in contact komt met water, moet het niet te veel worden uitgesteld om volledig op te lossen. Als een zout bijvoorbeeld weinig oplosbaar is in water, kan worden weggegooid als een sterke elektrolyt.
Ionische geleidbaarheid
Sterke elektrolyten zijn niet alleen erg oplosbaar in water, maar genereren ook een groot aantal ionen. Dankzij de elektrische kosten van deze ionen kunnen elektronen comfortabel de oplossingen afleggen. Dit wordt weerspiegeld in een toename van ionische geleidbaarheid met betrekking tot zuiver water. Daarom leiden ionische oplossingen zeer goed elektriciteit.
Kan u van dienst zijn: chloor: geschiedenis, eigenschappen, structuur, risico's, gebruikZoutoplossing neutraliteit
Veel zoutoplossing sterke elektrolyten, bij het oplossen in water, produceren geen pH -verandering. Dit betekent dat de oplossingen van deze zouten niet zuur of eenvoudig zijn, maar neutraal, met een pH bijna 7.
Er kunnen echter zure of basische zouten zijn die gemakkelijk in water kunnen worden opgelost, en die ook volledige ionen genereren. Bijvoorbeeld natriumcarbonaat2CO3, Lost op om na ionen te genereren+ en co32-, Maar de pH van de oplossing is basic.
Voorbeelden van sterke elektrolyten
 Natriumchloride is het meest representatieve voorbeeld van een sterke elektrolyt. Bron: Cristian V. /Cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0)
Natriumchloride is het meest representatieve voorbeeld van een sterke elektrolyt. Bron: Cristian V. /Cc by-sa (https: // creativeCommons.Org/licenties/by-sa/4.0) Sterke elektrolyten, die zoveel zijn, zijn verdeeld in drie classificaties: sterke zuren, sterke basen en oplosbaar zoutenproduct van neutralisaties tussen de eerste twee.
Sterke zuren
Sterke zuren bij het oplossen in water, zonder enig probleem, moeten de maximaal mogelijke hoeveelheid h produceren3OF+, Zuur moet dus volledig ion zijn; dat wil zeggen, het zou niet moeten bestaan als een neutraal molecuul met zure protonen zonder uit te brengen.
Voorbeelden van deze zuren zijn:
-HCL, zoutzuur, laat H -ionen vrij3OF+ en Cl-
-HF, fluorhorinezuur, geeft H -ionen vrij3OF+ en f-
-Hno3, Salpeterzuur, afgifte hones h3OF+ en niet3-
-HCLO4, perclorinezuur, geeft H -ionen vrij3OF+ en clo4-
-Hio4, periódiczuur, laat H -ionen vrij3OF+ en IO4-
-H2SW4, zwavelzuur, vrijgave hones h3OF+ En dus42-
De reden waarom het hydrium -ion, h3OF+, Het is altijd aanwezig (op de een of andere manier), het is omdat de waterstof die ze doneren door een watermolecuul wordt ontvangen:
HCL + H2O → H3OF+ + Klet-
De reactie is direct en onomkeerbaar. Dit is een kenmerk van een sterk zuur, dat op zijn beurt een sterke elektrolyt is vanwege zijn volledige ionisatie in water.
Kan u van dienst zijn: Alifatische koolwaterstoffen: eigenschappen, nomenclatuur, reacties, typenSterke honken
Sterke bases, oplost in water zonder enig probleem, moeten OH -ionen vrijgeven- van dezelfde kristallen, of onomkeerbaar onterecht een watermolecuul om ze te genereren.
Veel sterke bases bestaan uit ionen en niet -moleculaire vaste stoffen. Enkele voorbeelden van deze bases die zich gedragen als sterke elektrolyten zijn:
-Lioh, lithiumhydroxide, geeft oh ionen vrij- En Li+
-NaOH, natriumhydroxide, geeft oh ionen vrij- en NA+
-RBOH, Rubidio Hydroxide, brengt OH -ionen uit- en RB+
-CA (oh)2, calciumhydroxide, release oh ionen- en CA2+
-SR (OH)2, Strontiumhydroxide, release oh ionen- en meneer2+
-Ba (oh)2, Bariumhydroxide, release oh ionen- en BA2+
-NAH, natriumhydride, geeft oh ionen vrij- en waterstofgas, h2
-Nanh2, Natrium amiduro, los oh ionen vrij- en ammoniakgas, NH3
Je gaat uit
Hallobasi sterke elektrolyten bij het oplossen in water moeten volledig ion zijn. Velen van hen produceren geen pH -veranderingen. Dit komt omdat hun ionen zeer stabiel zijn, dus ze nemen niet deel aan hydrolysebalansen om de aard van het water te veranderen. Voorbeelden van deze zouten zijn:
-NaCl, natriumchloride, brengt na ionen vrij+ en Cl-
-Agno3, Zilvernitraat, release ag ionen+ en niet3-
-Oudere broer3, Natriumnitraat, afgifte van naionen+ en niet3-
-K2SW4, Kaliumsulfaat, geeft K -ionen vrij+ En dus42-
-Mgcl2, Magnesiumchloride, geeft mg -ionen vrij2+ en Cl-
-Cuso4, Kupric sulfaat, geeft ionen vrij2+ En dus42-
-KBR, kaliumbromide, brengt kionen vrij+ en br-
-NH4CL, ammoniumchloride, geeft NH -ionen vrij4+, Klet-, H3OF+ en ammoniakgas
Het kan u van dienst zijn: Mercurychloride (ii): structuur, eigenschappen, verkrijgen, gebruik-NACN, natriumcyanide, brengt na ionen vrij+ en CN-
-NA3Po4, Natriumfosfaat, brengt na ionen vrij+ en PO43-
-CRCL3, Chromisch chloride, brengt cr ionen vrij3+ en Cl-
-Aub3, Aurische bromide, geeft AU -ionen vrij3+ en br-
-SNSO4, Estany sulfaat, geeft snijwegen vrij2+ En dus42-
De NH4CL is een tegenstrijdig voorbeeld: het is volledig geïoniseerd, maar tegelijkertijd genereert het ammoniakneutrale moleculen omdat het een zuurzout is.
Verschillen tussen sterke en zwakke elektrolyt
Hoewel de verschillen tussen een sterke elektrolyt van een zwakke indirect zijn vastgesteld, zullen deze hieronder worden gepresenteerd als een conclusie:
-Sterke elektrolyten zijn erg oplosbaar in wateren; Zwakke elektrolyten zijn dat niet.
-De ionisatie van een zwakke elektrolyt is gedeeltelijk, wat betekent dat er neutrale moleculen in oplossing kunnen zijn. In plaats daarvan bestaan sterke elektrolyten exclusief als ionen.
-De zwakke zuren en basen, die op hun beurt zwakke elektrolyten zijn, dissociëren zich niet volledig in water, dus genereren ze minder ionen h3OF+ of oh- Wat kan worden verwacht.
-Halth -Halin Sterke elektrolyten zijn bijna niet gehydrolyseerd in vergelijking met zwakke elektrolyten. Daarom zijn de oplossingen van de eerste meestal neutraal, behalve wanneer ze omgaan met zuur of basissouten.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Sterke elektrolyt. Opgehaald uit: in.Wikipedia.borg
- Helmestine, Anne Marie, pH.D. (11 februari 2020). Sterke elektrolytdefinitie en voorbeeld. Hersteld van: Thoughtco.com
- Chung & Chieh. (5 juni 2019). Elektrolyten. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg

