Calomel -elektrodebedwerking, kenmerken, gebruik

- 852
- 208
- Irving McClure I
Hij Calomel -elektrode o Calomelanes is een secundaire elektrode die het mogelijk maakt om semi -leven potentialen te bepalen, dankzij de reactie die plaatsvindt tussen kwik en kwikchloride (I), Hg2Klet2, voorheen bekend als Calomel. Zowel reagentia, Hg als Hg2Klet2, Ze winnen of verliezen elektronen, afhankelijk van het medium waarin de elektrode wordt ondergedompeld.
Normaal gesproken afgekort als EC, vervangt deze elektrode in veel metingen door de standaard waterstofelektrode (zij), omdat het gemakkelijker te bouwen is en minder riskant is om te manipuleren (ondanks het feit dat ze kwik hebben). Binnenin bevat het een KCL -oplossing als een elektrolytisch medium voor elektronenstroom.
 Calomel -elektrode in volledige meting. Bron: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Calomel -elektrode in volledige meting. Bron: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons Calomel -elektrode kan verschillende varianten hebben, afhankelijk van de grootte of belangrijker, van de KCL -concentratie. Wanneer de KCL -oplossing verzadigd is, praten we over een electro van Saturado Calomel (ESC). De ESC is gemakkelijker te bereiden dan de EC, maar gevoeliger voor temperatuurveranderingen.
Het gebruik van deze elektrode heeft het mogelijk om de semi -levensgroepen te bepalen voor ontelbare redoxreacties. Het is ook een terugkerend apparaat in potentiometrische bepalingen, die proberen de hoeveelheid analyt te kennen, afhankelijk van de cel en gemeten potentieel.
[TOC]
Werking
Zodat de elektrode van Calomel werkt, het HG-HG-paar2Klet2 U moet reageren, of u nu wilt winnen of elektronen verliezen.
Kathodisch
Wanneer de reductie of versterking van elektronen binnen de Calomel -elektrode optreedt, hebben we de volgende reacties:
Hg2Klet2 → Hg22+ + 2cl- (Ionisatie)
Hg22+ + 2e- → 2HG (reductie)
Hg2Klet2 + 2e- → 2Hg +2cl- (Netto reactie)
Kan u van dienst zijn: exotherme reactieDaarom de Hg2Klet2 Win elektronen die tot metaalmercurius verminderen.
De potentiële e van de elektrode wanneer de reductie optreedt, wordt gegeven door de vergelijking:
E = Eº - 0.0591 Log [CL-]
Waar wordt opgemerkt dat het uitsluitend afhangt van de concentratie van de Cl -ionen-, Het standaardreductiepotentieel voor deze gemeten elektrode voor de standaard waterstofelektrode.
Anodisch
Binnen de elektrode kan een oxidatieproces ook optreden:
2HG → Hg22+ + 2e- (Oxidatie)
Hg22+ + 2cl- → Hg2Klet2 (Neerslag)
2Hg +2cl- → Hg2Klet2 + 2e- (Netto reactie)
Dat wil zeggen dat kwik oxideert om meer Hg te genereren2Klet2.
De potentiële E in dit geval wordt gegeven door:
E = eº + 0.0591 Log [CL-]
En nogmaals, en het hangt af van [CL-].
Algemene reactie
De algemene reactie voor de elektrode van Calomel is:
Hg2Klet2(s) + 2e- ⇌ 2HG (L) + 2cl-
Het gevoel van evenwicht hangt af van het medium waar de elektrode contact heeft. De Cl- Bepaal de oplosbaarheid van Hg2Klet2, die op zijn beurt invloed hebben op de vorming of oxidatie van de Hg.
En het potentieel bepaald voor een gespecificeerde concentratie van Cl -ionen- Het zal gelijk zijn aan:
ENcalomel = Erooster - ENos
Zijn Ecalomel Het potentieel dat wordt gerapporteerd als een referentie in bepaalde potentiële tabellen.
Kenmerken van de Calomel -elektrode
Weergave van de semi
Calomel -elektrode semi -geedge kan als volgt worden weergegeven:
PT | Hg | Hg2Klet2| Klet- (Xm)
Waar alleen de concentratie van Cl -ionen belangrijk is-, uitgedrukt in molariteit of normaliteit. De potentiële E van de elektrode zal variëren als deze gevuld is met oplossingen van verschillende KCL -concentraties.
Bijvoorbeeld een EC met KCL 0.1 m heeft A en gelijk aan 0.3356 V bij 25 ° C; Terwijl de ESC, met verzadigde KCL, één heeft en gelijk is aan 0.2444 V bij dezelfde temperatuur.
Kan u van dienst zijn: isopentano: structuur, eigenschappen, gebruik, verkrijgenDaarom is de KCL -concentratie het belangrijkste kenmerk van calomel -elektroden, omdat deze aangeeft wat te gebruiken wanneer de berekeningen van de potentiometrische metingen worden uitgevoerd.
Commercieel worden drie soorten calomel -elektroden bereikt: verzadigd (ESC), de negentiende (0.1 N of 0.1 m KCl) en de normale (1 N of 1 M KCl). Een elektrode van Calomel 1 m KCl zou worden weergegeven als:
PT | Hg | Hg2Klet2| Klet- (1 m)
Partijen
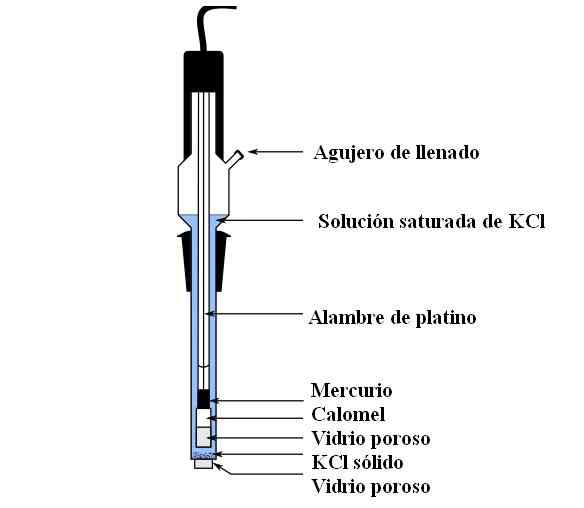 Calomel -elektrodeonderdelen. Bron: Bachi-Bouzou, CC0, via Wikimedia Commons
Calomel -elektrodeonderdelen. Bron: Bachi-Bouzou, CC0, via Wikimedia Commons In de bovenste afbeelding tonen we de belangrijkste onderdelen van een gewone Calomel -elektrode. Het is gemaakt van glas en bestaat uit twee containers: een externe, die wordt geplaatst in elektrochemisch contact met het medium van de metingen en de KCL -oplossing bevat; En een innerlijke, waar het Hg-Hg-mengsel rust2Klet2.
Intern bevat de Calomel -elektrode vloeibare kwik, waarop een Hg -pasta wordt nageleefd2Klet2 bevochtigd met kwik. Dit is de meest actieve fase van de elektrode. Het poreuze glas wordt gebruikt om alleen de ingang of uitgang van de Cl -ionen mogelijk te maken-, Maar niet de kristallen van HG2Klet2 of Mercury druppels.
Een platinakabel, waar elektronen stromen, is ondergedompeld in kwik en is verantwoordelijk voor het aansluiten van de elektrode met de voltmeter en het externe circuit in kwestie.
Door het vullende gat wordt de KCL -oplossing gegoten, die uitgelost kan worden opgelost. Ondertussen hebben we aan de onderkant van de elektrode een zeer kleine opening in een poreus glas, dat in direct contact komt met het medium van metingen. Het doel van het poreuze glas is om contact mogelijk te maken zonder ongewenste uitwisselingen van stoffen die de elektrode of het monster verontreinigen.
Het kan u van dienst zijn: cyclohexen: structuur, eigenschappen, synthese en gebruikVoordelen
De Calomel -elektrode presenteert de volgende voordelen met betrekking tot de standaard waterstofelektrode:
-Gemakkelijk te bouwen en te manipuleren
-Zijn celpotentieel blijft constant, zelfs als het water verdampt
-Je hebt geen zoutoplossing nodig
De ESC is het gemakkelijkst te bouwen uit Calomel -elektroden, omdat KCL voldoende is om op te lossen totdat hun kristallen zijn gevormd. Dan wordt de oplossing verzadigd en klaar om in de elektrode af te werpen.
Nadelen
De elektrode van Calomel presenteert echter de volgende nadelen:
-Door vloeibare kwik te bevatten, kan het een negatieve invloed hebben op het milieu
-Het kan niet worden gebruikt voor kwantitatieve analyses in monsters met een temperatuur hoger dan 60 ºC, omdat de Hg2Klet2 begint af te breken, waardoor elektrode -metingen mislukt
De ESC heeft ook het nadeel dat het erg gevoelig is voor temperatuurveranderingen.
Zilver zilverelektrode heeft Calomel vervangen in veel van de potentiometrische bepalingen.
Toepassingen
De elektrode van Calomel is een van de vele elektroden die dagelijks worden gebruikt in potentiometrische bepalingen, waardoor de semi -levens potentialen van analyten of interessante soorten kunnen worden verkregen.
Ook wordt de calomel -elektrode gebruikt in pH -metingen en cyclische voltmetry.
Referenties
- Dag, r., & Underwood, een. (1986). Kwantitatieve analytische chemie (Vijfde ed.)). Pearson Prentice Hall.
- Wikipedia. (2020). Verzadigde calomel -elektrode. Opgehaald uit: in.Wikipedia.borg
- Generalic, Eni. (20 oktober 2018). Elektrode calomel. Kroatisch-England Chemistry Dictionary & Glossary. KTF-split. 30 oktober. 2020. Hersteld van: woordenlijst.Periodni.com
- Skoog D.NAAR., West D.M. (1986). Instrumentale analyse. (Tweede ed.)). Inter -Amerikaans., Mexico.
- Hills, g., Ives, D. T. (1950). De Calomel -elektrode. Natuur 165, 530 doi.org/10.1038/165530A0
- Jmgav. (9 december 2012). Potentiometrie (II): elektroden. Opgehaald uit: Triplenlace.com
- « Socio -kritische paradigma -kenmerken, methoden, vertegenwoordigers
- Potentiometrie Fundamentals, vergelijkingen, elektroden »

