Potentiometrie Fundamentals, vergelijkingen, elektroden

- 3122
- 890
- Dewey Powlowski
De Potentiometrie Het is een elektrochemische analysetechniek die is gebaseerd op de meting van spanning, van een medium of compartiment, waarmee de activiteit of concentratie van een soort (ionisch of moleculair) van belang wordt bepaald. Het is een niet -destructieve techniek, omdat het niet probeert de chemische aard van de analyt in kwestie te wijzigen.
Om deze analyse uit te voeren, zijn ten minste twee elektroden onmisbaar: een van de referentie en een andere indicator of werk. Evenzo moet er een voltmeter met een hoge impedantie zijn, waarmee de spanningen worden gemeten zonder een merkbare elektronenstroom tussen de twee elektroden en de oplossingen die hen omringen toe te staan.
 Algemene weergave van de benodigde elementen voor een potentiometrische analyse. Bron: Gabriel Bolívar.
Algemene weergave van de benodigde elementen voor een potentiometrische analyse. Bron: Gabriel Bolívar. Hierboven hebben we een algemene weergave van de assemblage voor een potentiometrische analyse. In het compartiment waar de indicatorelektrode wordt geïntroduceerd, is de soort waarvan we de concentratie willen bepalen; In de referentie -elektrode hebben we een andere oplossing, waarin we de concentraties van zijn componenten kennen.
De geregistreerde spanningslezing is in principe te wijten aan de interessante soort die de indicatorelektrode nadert. Met deze spanning berekenen we de concentratie van deze soort, bijvoorbeeld die van ca ionen2+, Ag+, H+, NA+, K+, Klet-, enz. Potentiometrie heeft daarom gebruik van klinische, milieu-, analytische en fysicochemische chemie.
[TOC]
Fundamentals
De spanning die wordt bepaald in de potentiometrische analyses is die van de cel, encel, dat is het verschil tussen de spanningen veroorzaakt door de twee elektroden, de indicator en de referentie. De elektroden zijn gevoelig voor de activiteiten van de moleculen of ionen die hen omringen, in staat zijn om elektronen ervan te accepteren, of integendeel ze oplevert.
De twee compartimenten zijn verbonden, dus stroomt de elektrode -elektrode waarbij de reductie optreedt (kathode) naar de elektrode waar oxidatie (anode) plaatsvindt (anode).
Deze overdracht van elektronen (of stroom) is echter bijna nul, omdat anders de redoxreacties zouden evolueren om de concentraties en identiteiten van de betrokken soort volledig te wijzigen.
Kan u van dienst zijn: waterstofbromide (HBR)In plaats daarvan staat de voltmeter nauwelijks de doorgang van elektronen toe, zodat er een stabiele spanningslezing is en dat de cel de thermodynamische balans kan bereiken.
Er wordt daarom gezegd dat potentiometrie een niet -destructieve techniek is, omdat weinig ionen of moleculen worden omgezet in het meetproces, dat ook omkeerbaar is.
Hoofdvergelijkingen
Celpotentieel
Het potentieel van de cel is gerelateerd aan de activiteiten of concentraties van de interessante soort door de Nernst -vergelijking:
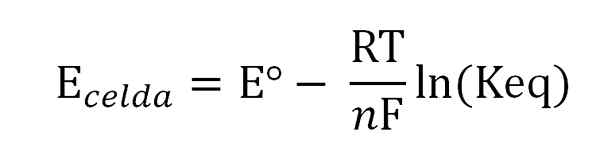 Nernst -vergelijking. Bron: Gabriel Bolívar.
Nernst -vergelijking. Bron: Gabriel Bolívar. Waarbij eº het potentieel is van dezelfde cel in standaardomstandigheden, f de faraday -constante, N Het aantal overgedragen elektronen, r de gasconstante, en Keq de balansconstante van de globale reactie. De berekeningen worden gemaakt door KEQ te wissen van het lezen van Ecel, en het berekenen van de gewenste concentratie van uw balansuitdrukking.
Het is echter handig om de concentraties te berekenen met een gemakkelijkere route. Volgens Verdrag wordt het potentieel van de cel ook gegeven door de volgende vergelijking:
ENcel = Erooster- ENos
Waar erooster Het is het potentieel voor de reductie semi -media, waarbij de indicatorelektrode zich bevindt; Terwijl eos Het is het potentieel voor oxidatie semi -media, waar we de referentie -elektrode hebben. De vergelijking kan dus worden herschreven als:
ENcel = Eindicator - ENreferentie + ENJ
Zijn EJ gelijk aan het potentieel veroorzaakt door de gezamenlijke brugverbindingen. In de praktijk, enJ Het kan niet worden bepaald, maar zorgt ervoor dat de waarde ervan zo minimaal mogelijk is met behulp van zeer verdunde oplossingen, of ervoor te zorgen dat de samenstellingen in beide compartimenten vergelijkbaar zijn.
Potentieel van de analyt
Van de vorige vergelijking kunnen we berekenen enindicator, dat is het potentieel dat ons echt interesseert. Met die waarde passen we de Nernst -vergelijking opnieuw toe:
Kan u van dienst zijn: acetonitril (C2H3N)ENindicator = Eº - (rt/nf) ln (rood/ox)
Netwerk is de verminderde vorm van de analyt of de soorten van interesse, en OX is de geoxideerde vorm. Ervan uitgaande dat de analyt de kationen Zn is2+ Op een metalen zinkelektrode zouden we hebben:
ENindicator = EºZn2+/Zn - (RT/NF) LN (1/naarZn2+))
Waar naarZn2+ Het is de Zn -kation -activiteit2+, die door experimentele aanpassingen vrij dicht bij de concentratie ligt, [Zn2+]. Uit deze vergelijking wordt de Zn -concentratie gewist2+, Dat zoals te zien is, heeft direct invloed op de waarde van Eindicator.
De verminderde vorm van zink, Zn, presenteert een activiteit gelijk aan 1. Daarom zal de algemene vergelijking voor roestige kationen van een metaal dat als een elektrode fungeert gelijk zijn aan:
ENindicator = EºMn+/m - (RT/NF) LN (1/naarM+N))
Maar dit is alleen van toepassing in het geval van eerste soortenelektroden.
Elektroden
Elektroden zijn naast voltmeter de belangrijkste elementen van elke potentiometrische analyse. Sommigen van hen zullen hieronder worden vermeld.
Eerste soort
De eerste soortelektroden zijn metalen die oxideren om kationen te veroorzaken, waardoor elektronen naar de voltmeter worden uitgevoerd. Sommige hiervan zijn de volgende: Ag, Zn, Cu, Hg, SN, TL, Cd en Bi.
Niet alle metalen dienen als eerste -klasse -elektroden, omdat ze geen kristallijne onregelmatigheden of oppervlakken moeten presenteren bedekt met oxidelagen die onstabiele spanningen veroorzaken.
Tweede soort
Tweede soortelektroden zijn daarentegen ook metaalachtig, maar bevatten ook een zout op hun oppervlak, waarvan de oplosbaarheid afhangt van de redoxreacties die plaatsvinden. Bijvoorbeeld Ag-AGCL en HG-HG-elektroden2Klet2 (Calomel), zijn tweede soortenelektroden.
Selectieve ionen
De selectieve ionelektroden, ook bekend als membranen, zijn die welke gevoelig zijn voor een specifiek ion of molecuul, dat door een membraan sluipt die alleen voor hem is ontworpen om te passeren en niet de andere soorten in oplossing.
Kan u van dienst zijn: beperkend en overmatig reagensHet favoriete voorbeeld van dit type elektrode is dat van glas, gebouwd om de concentratie van H -ionen te bepalen3OF+ of h+, En dienen dus als een pehometer.
Potentiometry -toepassingen
Milieuchemie
Potentiometrie is gebruikt bij de milieuchemie bij de bepaling van CN -ionen-, F- en niet3-, evenals ammoniak in waterstromen.
Klinische chemie
Selectieve elektroden zijn erg handig wanneer het meetmedia complex is. Daarom zullen de andere ionen of moleculen de metingen verstoren.
Dit kenmerk is vooral gunstig in de potentiometrische bepalingen die in dezelfde cellen worden uitgevoerd, waar micro -elektroden worden geïnjecteerd om de K K -concentraties te bepalen+, NA+, Klet-, AC2+ of h+.
Potentiometrische graden
Stel dat in het midden waar we de indicator -elektrode hebben, een titel wordt toegevoegd die reageert met de analyt en daarom zijn concentratie wijzigt. Dan zullen er veranderingen optreden in de Ecel, die op dezelfde manier overeenkomt met de pH-verandering in een zuur-base titratie.
Dus graferen encel Vs. VTitulant, We kunnen het keerpunt of de gelijkwaardigheid bepalen, en daarmee zullen we de concentratie van de analyt kennen.
Potentiometrische graden worden op grote schaal gebruikt in analytische en fysicochemische chemielaboratoria. Sommige van de analyten die met deze techniek kunnen worden bepaald, zijn de volgende: geloof2+, HCO3-, AC2+, Mg2+, Cu2+, Ascorbinezuur, haluros, onder andere.
Alle graden kunnen tot op zekere hoogte worden gevolgd via potentiometrisch in plaats van toevlucht te nemen tot de indicatoren en hun laatste punten.
Referenties
- Dag, r., & Underwood, een. (1986). Kwantitatieve analytische chemie (Vijfde ed.)). Pearson Prentice Hall.
- Skoog D.NAAR., West D.M. (1986). Instrumentale analyse. (Tweede ed.)). Inter -Amerikaans., Mexico.
- Dr. Doug Stewart. (2020). Definitie van potentiometrie. Hersteld van: chemicool.com
- Harvey David. (5 juni 2019). Potntiometrische methoden. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Britannica Encyclopaedia. (2020). Elektrogravimetrie. Hersteld van: Britannica.com
- Wikipedia. (2020). Elektroanalytische methoden. Opgehaald uit: in.Wikipedia.borg

