Differentiaal elektron

- 3096
- 515
- Kurt Aufderhar Jr.
Hij differentiaal elektron o Differentiator is het laatste elektron dat wordt geplaatst in de volgorde van de elektronische configuratie van een atoom. Hoe heet je? Om deze vraag te beantwoorden, is het noodzakelijk om de basisstructuur van een atoom te kennen: zijn kern, de leegte en de elektronen.
De kern is een dicht en compact aggregaat van positieve deeltjes die protonen worden genoemd, en neutrale deeltjes genaamd neutronen. De protonen definiëren het atoomnummer z en vormen samen met de neutronen de atoommassa. Een atoom kan echter niet alleen positieve ladingen dragen; Daarom draaien de elektronen rond de kern om het te neutraliseren.
 Basisatoomstructuur: hoofdsubatomaire deeltjes
Basisatoomstructuur: hoofdsubatomaire deeltjes Dus, voor elk proton dat bijdraagt aan de kern, wordt een nieuw elektron in zijn orbitalen opgenomen om de groeiende positieve lading tegen te gaan. Op deze manier is het nieuwe toegevoegde elektron, het differentiële elektron, nauw verwant aan het atoomnummer z.
Het differentiële elektron wordt gevonden in de buitenste elektronische laag: de Valencia -laag. Daarom, hoe verder de kern is, hoe groter de energie die ermee wordt geassocieerd. Deze energie is verantwoordelijk voor zijn deelname, evenals die van de rest van de Valencia -elektronen, in de chemische reacties die kenmerkend zijn voor de elementen.
[TOC]
Kwantumgetallen
Evenals de rest van de elektronen, kan het differentiële elektron worden geïdentificeerd door zijn vier kwantumnummers. Maar wat zijn de kwantumnummers? Ze zijn "N", "L", "M" en "S".
Het kwantumnummer "n" geeft de grootte van het atoom- en energieniveaus aan (k, l, m, n of, p, q). "L" is het secundaire of acemutale kwantumnummer, dat de vorm van de atomaire orbitalen aangeeft en waarden van 0, 1, 2 en 3 voor de orbitalen "S", "P", "D" en "F neemt ", respectievelijk.
Het kan u van dienst zijn: afgekapte kolf: kenmerken, waarvoor het is, types, gebruik"M" is het magnetische kwantumnummer en geeft de ruimtelijke oriëntatie van de orbitalen aan onder een magnetisch veld aan. Dus 0 voor de orbitale "S"; -1, 0, +1, voor de orbitale "p"; -2, -1, 0, +1, +2, voor de orbitale "d"; en -3, -2, -1, 0, +1, +2, +3, voor de orbitale "f". Ten slotte is het kwantumaantal spin "S" (+1/2 voor ↑ en -1/2 voor ↓).
Daarom heeft een differentiaal elektron de vorige kwantumnummers geassocieerd ("N", "L", "M", "S"). Omdat het de nieuwe positieve belasting tegengaat die wordt gegenereerd door het extra proton, biedt het ook het atoomnummer z van het element.
Hoe je het differentiële elektron kent?
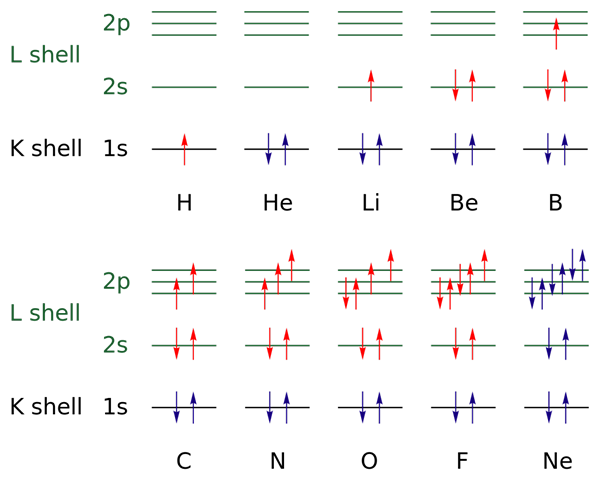
In het bovenste beeld worden elektronische configuraties weergegeven voor de elementen van waterstof tot neongas (H → NE).
Hierin worden de elektronen van de open lagen aangegeven met de kleur rood, terwijl die van de gesloten lagen worden aangegeven met de kleurblauw. De lagen verwijzen naar het kwantumnummer "n", de eerste van de vier.
Op deze manier voegt de Valencia -configuratie van de H (↑ van rood) een ander elektron toe met tegengestelde oriëntatie om dat van de HE te worden (↓ ↑, beide blauw omdat nu de niveau 1 is gesloten). Dit toegevoegde elektron is dan het differentiële elektron.
Aldus kan worden waargenomen hoe het differentiële elektron bijdraagt aan de valentielaag (rode pijlen) van de elementen, waardoor ze van elkaar differentiëren. De elektronen vullen de orbitalen met respect voor de zinkregel en het uitsluitingsprincipe van Pauling (perfect waargenomen van B tot de NE).
En hoe zit het met kwantumnummers? Deze definiëren elke pijl - dat wil zeggen elk elektron - en de waarden kunnen worden bevestigd door de elektronische configuratie om te weten of die van het differentiële elektron al dan niet zijn.
Het kan u van dienst zijn: wat zijn de negatieve effecten die we hebben met oplosbaarheid in water?Voorbeelden van differentiële elektronen in verschillende elementen
Chloor
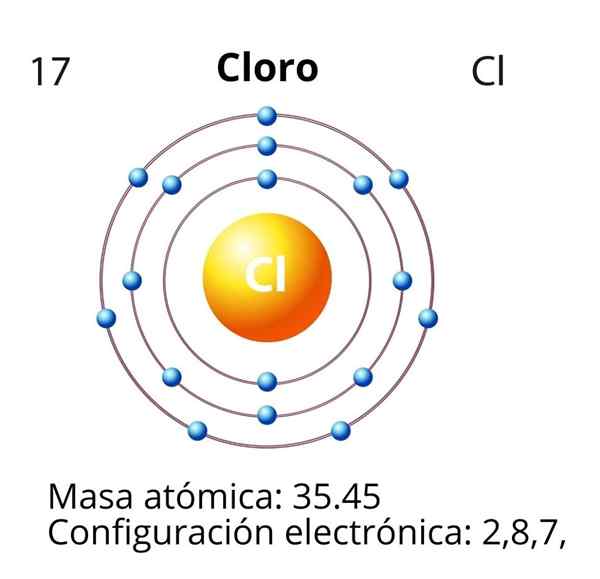
In het geval van chloor (CL) is het atoomnummer z gelijk aan 17. De elektronische configuratie is dan 1s22s2SP63S23P5. Orbitalen gemarkeerd in rood komen overeen met die van de Valencia -laag, die niveau 3 open presenteert.
Het differentiële elektron is het laatste elektron dat in de elektronische configuratie wordt geplaatst, en het chlooratoom is dat van de 3P -orbital, waarvan de beschikking als volgt is:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Met respect voor de zinkregel, worden de 3p -orbitalen eerst gevuld met gelijke energie (een opwaartse pijl in elke orbital). Ten tweede paren de andere elektronen met eenzaam van links naar rechts elektronen. Het differentiaalelektron wordt weergegeven in een groen frame.
Het differentiële elektron voor chloor heeft dus de volgende kwantumnummers: (3, 1, 0, -1/2). Dat wil zeggen, "n" is 3; "L" is 1, orbital "p"; "M" is 0, omdat het de orbitale "P" van het medium is; En "S" is -1/2, omdat de pijl naar beneden wijst.
Magnesium
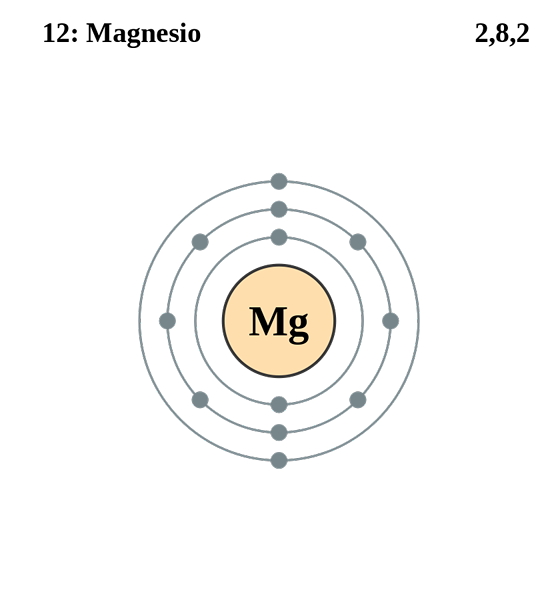 Elektronische magnesiumconfiguratie. Bron: elektron_shell_012_magnesium.SVG: Pumbaa (origineel werk van Greg Robson) Derivaatwerk: Kizar, CC BY-SA 3.0, via Wikimedia Commons
Elektronische magnesiumconfiguratie. Bron: elektron_shell_012_magnesium.SVG: Pumbaa (origineel werk van Greg Robson) Derivaatwerk: Kizar, CC BY-SA 3.0, via Wikimedia Commons De elektronische configuratie voor het magnesiumatoom is 1s22s2SP63S2, Het vertegenwoordigen van het orbitaal en zijn Valencia -elektron op dezelfde manier:
↑ ↓
3S
0
Deze keer heeft het differentiële elektron kwantumnummers 3, 0, 0, -1/2. Het enige verschil in dit geval ten opzichte van het chloor is dat het kwantumnummer "L" 0 is omdat het elektron een orbitale "S" bezet (de 3s).
Zirkonio
De elektronische configuratie voor het zirkoniumatoom (overgangsmetaal) is 1s22s2SP63S23P64S23D104P65s24d2. Op dezelfde manier als de vorige gevallen, is de weergave van de orbitalen en elektronen van Valencia als volgt:
Het kan u van dienst zijn: Cyclopentano (C5H10): structuur, eigenschappen en gebruik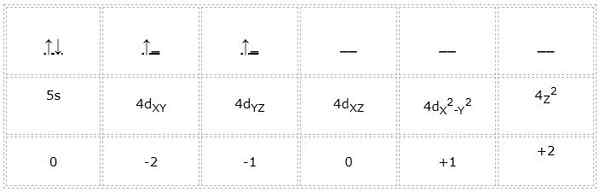
De kwantumnummers voor het in groen gemarkeerde differentiële elektron zijn dus: 4, 2, -1, +1/2. Hier, aangezien het elektron de tweede orbitale "d" bezet, heeft het een kwantumnummer "m" gelijk aan -1. Omdat de pijl naar boven wijst, is het spinnummer "S" gelijk aan +1/2.
Onbekend element
De kwantumaantallen van het differentiële elektron voor een onbekend element zijn 3, 2, +2, -1/2. Wat is het atoomnummer z van het element? Weten dat Z kan ontcijferen wat het element is.
Deze keer, als "n", betekent dit dat het element zich in de derde periode van het periodiek systeem bevindt, met "D" orbitalen als Valencia -laag ("L" gelijk aan 2). Daarom worden orbitalen weergegeven zoals in het vorige voorbeeld:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
De kwantumnummers "m" gelijk aan +2, en "s" gelijk aan -1/2, zijn cruciaal om het differentiële elektron correct te vinden in de laatste 3D -orbital.
Het gezochte element heeft dus 3D -orbitalen10 Vol, zoals zijn interne elektronische lagen. Concluderend is het element metaalzink (Zn).
De kwantumaantallen van het differentiële elektron kunnen echter niet onderscheiden tussen zink en koper, omdat dit laatste element ook 3D -orbitalen volledig presenteert. Omdat? Omdat koper om kwantumredenen een metaal is dat mislukt met de regels van gevuld met elektronen.
Referenties
- Jim Branson. (2013). Sink's regels. Opgehaald uit kwantummechanica.UCSD.Edu
- Lezing 27: Sink's regels. Hersteld van pH.Qmul.AC.Uk
- Purdue universiteit. Kwantumnummers en elektronenconfiguraties. Opgehaald van Murmed.Chem.Purdue.Edu
- Salvat Encyclopedia of Science. (1968). Salvat Physics, s.NAAR. van Pamplona Editions, Deel 12, Spanje, p. 314-322.
- Walter J. Moore. (1963). Fysische chemie. In Deeltjes en golven. Vierde editie, Longmans.

