Metaalkarakter
- 1593
- 66
- Lonnie Rohan
Wat is het metalen karakter?
Hij Metaalkarakter van de elementen Het periodiek systeem verwijst naar al die variabele, chemische en fysische, die metalen definiëren of onderscheiden van andere stoffen van de natuur. Ze zijn meestal helder, dicht, harde, hoge thermische en elektrische, vormbare en ductiele geleidbaarheid.
Niet alle metalen vertonen echter dergelijke kenmerken; In het geval van kwik is dit bijvoorbeeld een heldere zwarte vloeistof. Ook hangen deze variabelen af van de terrestrische druk en temperatuuromstandigheden. Blijkbaar kan bijvoorbeeld niet -metalen waterstof zich fysiek gedragen als een metaal in extreme omstandigheden.
Deze omstandigheden kunnen zijn: onder verschrikkelijke druk of zeer koude temperaturen rond de absolute nul. Om te bepalen of een element metaalachtig is of niet, is het noodzakelijk om verborgen patronen in de ogen van de waarnemer te overwegen: atoompatronen.
Deze discrimineren meer precisie en betrouwbaarheid wat de metaalelementen zijn, en zelfs welk element metallic is dan een ander.
Op deze manier berust het ware metalen karakter van een gouden munt meer op de kwaliteiten van zijn atomen dan die bepaald door zijn gouden massa, zelfs beide zijn nauw verwant.
Welke van de munten is meer metaalachtig: een van goud, een van koper of een platina? Het antwoord is platina en de uitleg ligt in zijn atomen.
Hoe varieert het metalen karakter van de elementen in het periodiek systeem?
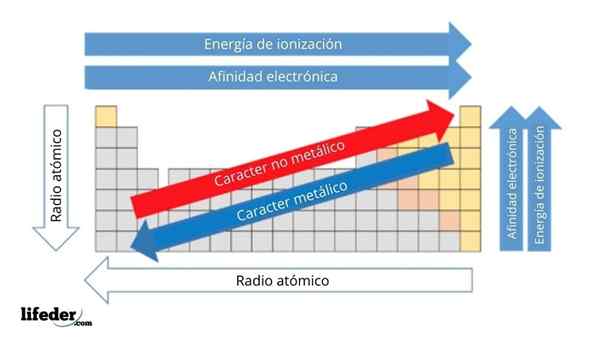
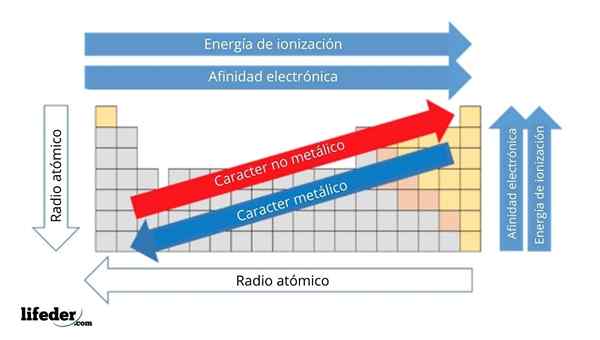
In de bovenste afbeelding heeft u de periodieke eigenschappen van de elementen. De rijen komen overeen met de periodes en kolommen met de groepen.
Het metalen karakter neemt af van links naar rechts van het periodiek systeem en neemt toe in de tegenovergestelde richting. Evenzo neemt het metalen karakter toe van boven naar beneden en neemt af naarmate de periodes naar groepshoofden worden afgelegd.
Het kan u van dienst zijn: Bases: kenmerken en voorbeeldenOp deze manier hebben de elementen die dicht bij de richting liggen waarop de pijlpunt wijst, een groter metaalkarakter dan die in de tegenovergestelde richting (de gele blokken).
Bovendien komen de andere pijlen overeen met andere periodieke eigenschappen, die definiëren in welke zin ze toenemen of afnemen als het element "metaalachtig" is. Bijvoorbeeld, de elementen van de gele blokken, hoewel ze een laag metaalkarakter hebben, zijn hun elektronische affiniteit en ionisatie -energie hoog.
In het geval van atomaire radio's, hoe groter, hoe meer metaalachtig het element is; Dit wordt aangegeven door de blauwe pijl.
Eigenschappen van metalen elementen
In het periodiek systeem wordt waargenomen dat metalen grote atoomradio's, lage ionisatie -energieën, lage elektronische affiniteiten en lage elektronegativiteiten hebben. Hoe al deze eigenschappen te onthouden?
Het punt waarnaar ze stromen is de reactiviteit (elektropositiviteit) die metalen definieert, die oxideren; dat wil zeggen, ze verliezen gemakkelijk elektronen.
Wanneer ze elektronen verliezen, vormen metalen kationen (m+)). Daarom vormen de elementen met de hoogste metalen karakter gemakkelijker kationen dan die van een lager metaalkarakter.
Een voorbeeld van het bovenstaande is om rekening te houden met de reactiviteit van de elementen van groep 2, de alkalinotherreuze metalen. Beryllium is minder metaalachtig dan magnesium, en dit is op zijn beurt minder metaalachtig dan calcium.
Dus tot het bereiken van de metalen bario, de meest reactieve van de groep (na de straal, radioactief element).
Hoe beïnvloedt de atomaire straal op de reactiviteit van metalen?
Naarmate de atomaire straal toeneemt, zijn de elektronen van Valencia verder weg van de kern, dus worden ze behouden met minder kracht in het atoom.
Kan u dienen: natriumhydroxide (NaOH): structuur, eigenschappen, gebruik, syntheseAls er echter een periode naar de rechterkant van het periodiek systeem wordt afgelegd, voegt de kern protonen toe aan zijn lichaam, nu positiever, die valentie -elektronen sterker aantrekt, waardoor de grootte van de atoomradius wordt verminderd. Dit resulteert in een afname van het metalen karakter.
Aldus wordt een zeer klein atoom en met een zeer positieve kern de neiging elektronen te winnen in plaats van ze te verliezen (niet -metalen elementen), en die die zowel elektronen kunnen winnen als verliezen, worden beschouwd als metalloides. Boor, silicium, germanio en arseen zijn enkele van deze metalloïden.
Aan de andere kant neemt de atomaire straal ook toe als er nieuwe energiebeschikbaarheid is voor andere orbitalen, die optreedt bij het afdalen in een groep.
Om deze reden worden de radio's om om deze reden in het periodiek systeem af te dalen en wordt de radio's niet in staat om te voorkomen.
In het laboratorium, met een sterk oxidatiemiddel -achtig verdund salpeterzuur (HNO3)- Metaalreactiviteiten in het gezicht van oxidatie kunnen worden bestudeerd.
Evenzo zijn de vormingsprocessen van hun metaalhalogeniden (bijvoorbeeld NaCl) ook demonstratieve experimenten van deze reactiviteit.
Element van een groter metaalkarakter
 Cesium
Cesium De richting van de blauwe pijl in het beeld van de periodiek systeem leidt tot de elementen van Francio en Cesio. De Francio is meer metaalachtig dan het cesium, maar in tegenstelling tot het laatste is de Francio kunstmatig en radioactief. Om deze reden bezet Cesium de plaats van het natuurlijke element van een groter metaalkarakter.
Kan u van dienst zijn: ijzeroxideIn feite is een van de bekendste (en explosieve) bekende reacties degene die optreedt wanneer een stuk (of druppels) cesium in contact komt met water.
De hoge reactiviteit van het cesium, ook vertaald in de vorming van veel stabielere verbindingen, is verantwoordelijk voor de plotselinge afgifte van energie:
2cs (s) + 2H2O → 2csoh (aq) + h2(G)
De chemische vergelijking maakt het mogelijk om de oxidatie van cesium en de reductie van waterwaterstof tot gasvormige waterstof te zien.
Element van een lager metaalkarakter
 3D fluormodel
3D fluormodel In de tegenovergestelde diagonaal, in de rechterbovenhoek van het periodiek systeem, fluoride (f2, superieure afbeelding) leidt de lijst met niet -metalen elementen. Omdat? Omdat het het element is in de meest elektronegatieve aard en die met de laagste ionisatie -energie.
Met andere woorden, het reageert met alle elementen van het periodiek systeem om het ionen f te vormen- en niet f+.
Fluor is zeer onwaarschijnlijk dat het elektronen verliest in een chemische reactie, vrij in strijd met metalen. Het is om deze reden dat het het element is van een lager metaalkarakter.
Referenties
- Lumen, chemie voor niet-majors. Metaalachtig en niet -metaalkarakter. Hersteld van cursussen.Lumenarning.com
- Chemie -toewijzing. (2018). Elektropostiviteit of metaalkarakter. Hersteld van chemie-toewijzing.com
- Juan Ramos. Volledige lijst met metalen en niet -metalen. Hersteld van sciencetrends.com
- Anne Marie Helmestine, pH.D. Metallische karaktereigenschappen en trends. Hersteld van ThoughtCo.com

