Dodecil natriumsulfaat (SDS) structuur, eigenschappen, gebruik
- 4514
- 792
- Kurt Aufderhar Jr.
Hij Natriumsulfaat dodecyl (SDS), is een anionisch, synthetisch en amfiphyllisch organisch zout. Het apolaire en hydrofobe deel komt overeen met de koolwaterstofketen; Terwijl het polaire en hydrofiele deel te wijten is aan sulfaat, met negatieve belasting.
De SDS is een oppervlakteactieve stof: de moleculen worden op het oppervlak van waterige oplossingen geplaatst, waardoor een afname van de oppervlaktespanning produceert. Deze functie maakt het gebruik ervan in shampoo, tandcrèmes, zeep en andere artikelen van persoonlijke verzorging en huisreiniging mogelijk.
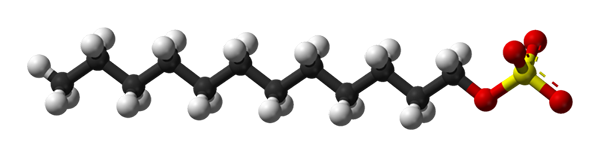
 Natriumsulfaat dodecile structuur. Bron: Benjah-bmm27 via Wikipedia.
Natriumsulfaat dodecile structuur. Bron: Benjah-bmm27 via Wikipedia. Natriumsulfaatdodecyl bindt aan eiwitten en produceert de zich ontvouwende, het verwerven van een langwerpige vorm. De sulfaatgroepen worden blootgesteld aan water en verwerven negatieve belastingeiwitten, waarvan het aantal evenredig is met het molecuulgewicht daarvan.
Om deze reden maakt de SDS de bepaling van de molecuulgewichten van de eiwitten mogelijk door elektroforese in polyacrylamide.
Hoewel een mogelijk carcinogeen effect van de SDS is vermoed, is het niet definitief aangetoond dat het zo is. SD's kunnen, net als andere wasmiddelen, irritatie van huid en ogen produceren.
[TOC]
SDS -structuur
In het eerste beeld werd het SDS -molecuul getoond met een bollen en barsmodel. Zoals te zien is, heeft het een hydrofobe en apolaire koolstofstaart (zwart -witte bollen); En tegelijkertijd een poolhoofd, dankzij de aanwezigheid van de groep -SO4- (gele en rode bollen).
Hoewel het niet wordt getoond, moet er een paarse bol zijn die het na -kation vertegenwoordigt+, Direct naast de groep -So4-, Elektrostatisch op elkaar inwerken.
Dat gezegd hebbende, het wordt met het blote oog begrepen waarom deze verbinding amfifyllisch is; en ook een anionische spanning, omdat de belasting van de SDS negatief is en andere kationen kan aantrekken naast de NA+.
Het molecuul geeft de valse indruk van rigide, een onbeweegbare lineaire structuur. Het is echter allemaal het tegenovergestelde. De SDS kan worden vergeleken met een "worm", waarvan de koolstofstaart meerdere trillingen en rotaties van zijn eenvoudige links presenteert. Dit maakt hem in staat om verschillende conformaties of vouwen in het midden aan te nemen; In water bijvoorbeeld.
Kristallen
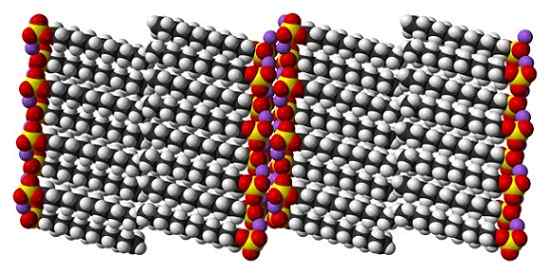 Kristalstructuur van dodecyl natriumsulfaat. Bron: Benjah-bmm27 [Public Domain]
Kristalstructuur van dodecyl natriumsulfaat. Bron: Benjah-bmm27 [Public Domain] Hoewel het waar is dat natriumsulfaatdodecyl een dynamisch molecuul is, hoeft het in vaste toestand niet te veel te bewegen, zich gedragen als een "eenvoudige" balk. En dus wordt elk molecuul of balk zodanig geplaatst dat de interacties tussen koolzuurhoudende wachtrijen en tegelijkertijd die van hun ionische belastingen toenemen.
Kan u van dienst zijn: natriumchloriet (NaClo2): structuur, eigenschappen, gebruik, risico'sHet resultaat is de vorming van een monoklinisch kristal, waarbij SDS -moleculen worden verpakt in verschillende staafkolommen (bovenste afbeelding). De intermoleculaire krachten die ze verenigen, zijn zodanig, dat deze kristallen een temperatuur van 206 ° C vereisen om de vloeibare fase te smelten.
Micellen
Buiten het comfort van zijn kristallen kan het SDS -molecuul niet langer stil blijven; Begin zijn staart te draaien om interacties met de buitenste omgeving te vergroten of te verminderen.
Als dit medium water is, treedt een fenomeen op dat micella -formatie wordt genoemd: koolstof en hydrofobe staarten binden om zichzelf te omringen, terwijl polaire koppen, groepen -So4-, Ze blijven op het oppervlak interactie met H -moleculen2OF.
Vervolgens verwerft de Micella een Oblate Ellipsoïde morfologie (zoals de aarde, maar meer verpletterd). In het kristal zijn ze als staafblokken, en in een waterig medium zoals ellipsoïde micellen. Wat als het medium olie was? De myce zou worden geïnvesteerd: de polaire hoofden zo4- Ze zouden naar de kern gaan, terwijl hun koolzuurhoudende staarten zouden worden blootgesteld aan olie.
Eigenschappen
Namen
- Natriumdodecilsulfaat (SDS).
- Natrium Laurilsulfate (SLS).
Moleculaire formule
C12H25OF4SNA.
Molaire massa
288,378 g/mol.
Fysieke beschrijving
Verschillende presentaties: droog stof, vloeistof of vochtige vaste stof. Zijn kristallen hebben een witte of romige kleuring.
Geur
Vader ruik naar dikke stoffen, toilet.
Smeltpunt
206 ºC.
Oplosbaarheid in water
1 · 105 mg/l. 1 g opgelost in 10 ml van een opalescentoplossing.
Dikte
1.01 g/cm3.
Stabiliteit
Het is stabiel onder de aanbevolen opslagomstandigheden.
Ontleding
Wanneer verwarmd tot ontleding stoot een witte rook van zwaveloxide en natriumoxide uit.
Oppervlaktespanning
39,5 dynas/cm bij 25 ºC.
Kritische molaire concentratie
Is 8,2 mm in zuiver water bij 25 ° C.
Toepassingen
Persoonlijke verzorging en schoonmaken thuis
Sulfaatdodecyl is een oppervlakteactieve stof die wordt gebruikt in tal van producten, zoals toiletzepen, schuimbaden, scheermescrèmes, enz. Het wordt ook gebruikt om vlekken uit de moeilijkheid te verwijderen om te verwijderen, bij het reinigen van de vloeren en badkamers, het verstoren van de keukenartikelen, enz.
Kan u van dienst zijn: olie of benzine -ether: formule, structuur, gebruikVeterinaire en menselijke geneeskunde
Het wordt gebruikt als een afstotend van vlooien en teken, aanwezig bij dieren. Het wordt ook gebruikt als een vochtinbrengende crème in sommige antibiotica, voor mondeling of actueel gebruik.
De SDS is microbicide tegen virussen met verpakking, zoals HIV, types 1 en 2, en het herpes eenvoudige herpesvirus (HSV-2). Het werkt ook op virus zonder in te wikkelen: papillomavirus, reovirus, rotavirus en poliovirus. Dit gebruik is echter niet goedgekeurd.
Het gebruik van SDS is voorgesteld als een vaginale douche die bescherming biedt tegen seksueel overdraagbaar virus. Ook bij het verwerken van moedermelk om de mogelijkheid van HIV -transmissie te elimineren of te verminderen.
Naast zijn antivirale werking werkt de SDS op pathogene bacteriën en schimmels. SDS elimineert resistentie tegen geneesmiddelen en seksuele resistentiefactoren uit E. coli; en blokkeert de groei van talloze positieve grambacteriën.
Bij het laboratorium
De SDS bindt aan eiwitten die hun denaturatie veroorzaken, waardoor negatieve belastingen en een conformationele verandering zorgen. Dit maakt het mogelijk om zijn molecuulgewichten te bepalen door elektroforese in polyacrylamide.
SDS wordt ook gebruikt bij het bereiden van hersenweefselmonsters voor gebruik in optische microscopie. Het wordt ook gebruikt bij de bereiding van bloedmonsters voor het aantal erytrocyten.
De SDS wordt gebruikt bij de zuivering van nucleïnezuren, vanwege hun vermogen om de membranen op te lossen en hun remmende werking op de activiteit van Arnasa en DNAASA -enzymen.
Bovendien wordt het SDS gebruikt bij de karakterisering van quaternaire ammoniumverbindingen.
Voedseladditief
SDS wordt gebruikt als een emulgator en de verdikking van voedsel. Verbetert de stabiliteit en textuur van gebakken producten. Bovendien wordt het gebruikt als hulpmiddel in gedroogde ei -producten.
Kan u van dienst zijn: zinknitraat: structuur, eigenschappen, verkrijgen, gebruikIndustrie
De SDS wordt gebruikt in de galvanoplastiekindustrie, met name nikkel en zink; als emulgerende en penetrerende vernis- en schilderverwijderaar; bij de formulering van explosieven gevormd door injectie; En in solide raketten zoals schuimen.
Risico's
SDS -constante blootstelling kan huidhyperplasie veroorzaken bij cavia's. Konijnen en mensen zijn minder vatbaar voor deze verwondingen. Direct contact met SDS in een concentratie ≤ 20%, kan matige ontsteking en huidirritatie veroorzaken.
Aan de andere kant kan langdurige blootstelling aan SD's dermatitis produceren, met tekenen van roodheid, zwelling en ampules -vorming.
SD's kunnen produceren door contact irritatie. Het kan ook bij sommige mensen erg reactief zijn en inhalatie -irritatie van luchtwegen en luchtwegen veroorzaken.
Zelden kan SDS -inname bijtende laesies veroorzaken. Maar het is gemeld bij kinderen die SDS hebben ingenomen, overvloedig braken van snelle ontwikkeling, CNS -depressie en ademhalingsklachten.
Er is geen bewijs van genotoxiciteit of teratogene werking gevonden in het SDS. Bij 242 patiënten met eczemateuze dermatitis werd 6,4 % van de patiënten met allergie gevonden, te wijten aan het gebruik van SDS.
Referenties
- Structurele gegevens van L. NAAR. Smith, r. B. Hammond, K. J. Roberts, D. Machin, g. McLeod (2000). Bepaling van de kristalstructuur van watervrij natriumdodecylsulfaat met behulp van een combinatie van sychrotron -stralingspoeder diffractie en moleculaire modelleringstechnials. Journal of Molecular Structure 554 (2-3): 173-182. Doi: 10.1016/S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Natriumdodecylsulfaat. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Natriumdodecylsulfaat. PubChem -database. CID = 3423265. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Hammouda B. (2013). Temperatuureffect op de nanostructuur van SDS -micellen in water. Journal of Research of the National Institute of Standards and Technology, 118, 151-167. Doi: 10.6028/jres.118.008
- Elsevier. (2019). Natriumdodecylsulfaat. Wetenschap direct. Opgehaald uit: Scientedirect.com
- Kumar, s., Thejajenuo, j. K. en tsipila, t. (2014). Toxicologische effecten van natriumdodecylsulfaat. Journal of Chemical and Pharmaceutical Research 6 (5): 1488 - 1492.
- Gegevensnetwerk voor toxicologie. (S.F.)). Natriumlaurylsulfaat. Toxet. Hersteld van: toxnet.NLM.NIH.Gov
- « Tertiaire structuur van de kenmerken van de belangrijkste kenmerken
- Fosfatidilserine -structuur, synthese, functies, locatie »

