Tertiaire structuur van de kenmerken van de belangrijkste kenmerken

- 4080
- 1236
- James Dach
De Tertiaire structuur van eiwitten Het is de drie -dimensionale conformatie die polypeptideketens verwerven bij het vouwen op zichzelf. Deze conformatie verschijnt door interacties tussen de laterale ketens van het aminozuurafval van het polypeptide. Zijketens kunnen onafhankelijk van hun positie in het eiwit interageren.
Omdat het afhangt van de interacties tussen R -groepen, vertoont de tertiaire structuur niet -repetitieve aspecten van de keten, omdat deze groepen verschillen voor elk aminozuurresidu. Secundaire structuur daarentegen hangt af van carboxyl- en aminogroepen, die aanwezig zijn in alle aminozuren.
 Tertiaire structuur van het kinasefosfatase -eiwit, met secundaire structuren in alfa en bètablad. Genomen en bewerkt uit: A2-33. Aangepast door Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Tertiaire structuur van het kinasefosfatase -eiwit, met secundaire structuren in alfa en bètablad. Genomen en bewerkt uit: A2-33. Aangepast door Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Sommige auteurs suggereren dat vezelachtige eiwitten een eenvoudige tertiaire structuur hebben, maar toch wijzen andere auteurs erop dat deze structuur typerend is voor bolvormige eiwitten.
[TOC]
Vezelige eiwitten
In vezelachtige eiwitten zijn polypeptideketens gerangschikt in de vorm van lange filamenten of lange vellen; Ze bestaan over het algemeen uit een uniek type secundaire structuur. Deze secundaire structuur is in de meeste gevallen belangrijker dan de tertiaire structuur bij het bepalen van de eiwitvorm.
De biologische functie ervan is structureel, waardoor kracht en/of elasticiteit wordt verleend aan de organen en structuren waar ze worden gevonden, terwijl ze bij elkaar worden gehouden. Alle vezelachtige eiwitten zijn onoplosbaar in water, vanwege de grote hoeveelheid hydrofobe aminozuren die ze presenteren.
Onder deze vezelachtige eiwitten zijn keratines en collageen. De eerste worden gevonden in conjunctieve stoffen en in structuren zoals haren, nagels (α-queratinas), schalen en veren (β-cheatins). Collageen wordt ondertussen gevonden in botten, pezen en huid, onder anderen.
α-queratinas
Deze eiwitten maken deel uit van de zo -aangedreven tussenliggende filamenten -eiwitten, die een belangrijke rol spelen in het cytoskelet van meercellige organismen. Bovendien zijn ze het belangrijkste bestanddeel van haren, nagels, wol, hoorns, hoeven en een van de belangrijkste dierenhuideiwitten.
Kan u van dienst zijn: Kinyoun -kleuringDe structuur van het molecuul is een a -propeller. Twee strengen α-queratine kunnen parallel worden gerangschikt en de ene over de andere inschrijven met hun R-hydrofobe groepen die tussen hen op elkaar inwerken. Op deze manier wordt een superhelische of balstructuur gemaakt met wikkeling naar links.
De tertiaire structuur van a keratine is eenvoudig en wordt gedomineerd door de secundaire structuur van a-helix. Aan de andere kant is de quaternaire structuur ook aanwezig, omdat twee moleculen deelnemen aan de superhelicoïde structuur, die interageert door niet -covalente bindingen.
β-Queratinas
De primaire structuur is vergelijkbaar met die van α-queratinas, maar de secundaire structuur wordt gedomineerd door β-vellen. Ze zijn het belangrijkste bestanddeel van de schalen van de reptielen en de veren van de vogels.
Collageen
Dit eiwit kan meer dan 30% van de totale eiwitmassa van sommige dieren vertegenwoordigen. Het wordt gevonden in Cartilagos, botten, pezen, hoornvlies en huid, onder andere weefsels.
De secundaire structuur van het collageen is uniek en wordt voor elke ronde weergegeven door een Levogira -propeller met 3,3 aminozuurafval. Drie levogyous propeller -ketens (α).
Tropocollagen -moleculen komen samen om een collageenvezel te vormen met een grote weerstand, hoger dan staal en vergelijkbaar met koper met een hoge weerstand.
Andere vezelachtige eiwitten
Andere soorten vezelachtige eiwitten zijn fibroine en elastine. De eerste van hen wordt gevormd door β -vellen, voornamelijk gevormd door Glycina, Alanine en Serine.
De laterale ketens van deze aminozuren zijn klein, zodat ze nauw kunnen worden verpakt. Het resultaat is een vezel die zowel zeer resistent als zeer onverkoopd is.
Kan u bedienen: fosfaatbuffer (PBS): fundering, voorbereiding en gebruikIn het elastine vervangt de valine ondertussen de serine door zijn hoofdbestanddelen aminozuren. In tegenstelling tot fibroine is elastine zeer uitbreidbaar, vandaar zijn naam. In de constitutie van het molecuul werkt Lysine ook, die kunnen deelnemen aan kruisverkoppeling waardoor elastine zijn vorm kan herstellen wanneer de spanning ophoudt.
Bolvormige eiwitten
Globale eiwitten zijn, in tegenstelling tot vezelachtig, oplosbaar en hebben over het algemeen verschillende soorten secundaire structuren. Hierin zijn echter belangrijker drie -dimensionale conformaties die ze verwerven bij het vouwen op zichzelf (tertiaire structuur).
Deze specifieke drie -dimensionale conformaties geven specifieke biologische activiteit aan elk eiwit. De belangrijkste functie van deze eiwitten is regulerend, zoals bij enzymen.
Kenmerken van de tertiaire structuur van bolvormige eiwitten
De tertiaire structuur van bolvormige eiwitten heeft enkele belangrijke kenmerken:
- Globale eiwitten zijn compact dankzij de verpakking wanneer de polypeptideketen vouwt.
- Het verre aminozuurafval in de primaire structuur van polypeptideketens is dichtbij en kunnen met elkaar omgaan vanwege de vouw.
- Grotere bolvormige eiwitten (meer dan 200 aminozuren) kunnen verschillende compacte segmenten hebben, onafhankelijk tussen hen en met bepaalde functies, en elk van deze segmenten wordt domein genoemd. Een domein kan tussen 50 en 350 aminozuurafval hebben.
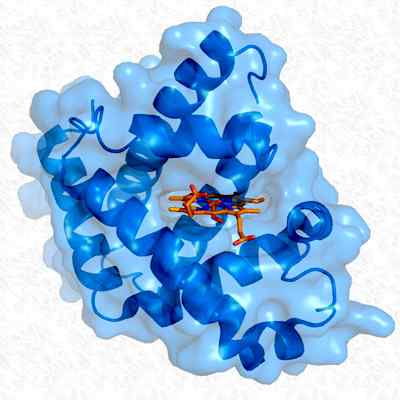 Tertiaire structuur van myoglobine. Genomen en bewerkt uit: Thomas SplettsEsser. Aangepast door Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Tertiaire structuur van myoglobine. Genomen en bewerkt uit: Thomas SplettsEsser. Aangepast door Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Algemene regels voor het vouwen van globale eiwitten
Zoals reeds opgemerkt, hebben eiwitten bepaalde vouwvormen, die ze ook bepaalde kenmerken geven. Deze vouwing is niet willekeurig en wordt begunstigd zowel door de primaire als de secundaire structuur en door sommige niet -covalente interacties, en er zijn ook enkele fysieke beperkingen aan het vouwen, dus sommige regels zijn geformuleerd:
Kan u van dienst zijn: primaire lymfoïde organen- Alle bolvormige eiwitten hebben gedefinieerde distributiepatronen, met hydrofobe groepen gericht in het molecuul en hydrofiel afval in de buitenste laag in de buitenste laag. Hiervoor zijn ten minste twee lagen secundaire structuur vereist. De β-a-β-lus en het α-α vertex kunnen die twee lagen bijdragen.
- De β -vellen zijn over het algemeen gerangschikt in een Levogira -geramde vorm.
- In een polypeptideketen kunnen verschillende bochten optreden om van een secundaire naar een andere structuur te gaan, zoals β- of γ -bochten, die de richting van de keten kunnen investeren in vier aminozuurafval of minder.
- Globulaire eiwitten hebben α, β -vellen, onregelmatig gestructureerde wendingen en segmenten.
Eiwit denaturatie
Als een eiwit zijn natieve (natuurlijke) drie -dimensionale structuur verliest, verliest het zijn biologische activiteit en de meeste van zijn specifieke eigenschappen. Dit proces staat bekend als denaturatie.
Denaturatie kan optreden wanneer natuurlijke omgevingscondities veranderen, bijvoorbeeld door verschillende temperatuur of pH. Het proces is in veel eiwitten onomkeerbaar; Anderen kunnen echter spontaan hun natuurlijke structuur herstellen door de normale omgevingscondities te herstellen.
Referenties
- C.K. Mathews, k.EN. Van Hold & K.G. Ahern (2002). Biochemerie. 3e editie. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemery. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemerie. 5e editie. W. H. Freeman en bedrijf.
- W.M. Becker, l.J. Kleinsmith & J. Hardin (2006) Wereld van de cel. 6e editie. Pearson Education Inc.
- NAAR.Lehninger (1978). Biochemie. Omega Editions, s.NAAR.
- T. McKee & J.R. McKee (2003). Biochemie: de moleculaire basis van het leven. 3e editie. The McGraw-Hiii Companies, Inc.
- « Fermionische condensaatseigenschappen, toepassingen en voorbeelden
- Dodecil natriumsulfaat (SDS) structuur, eigenschappen, gebruik »

