Difenylamine
- 1111
- 41
- Lonnie Rohan
Wat is de defilamine?
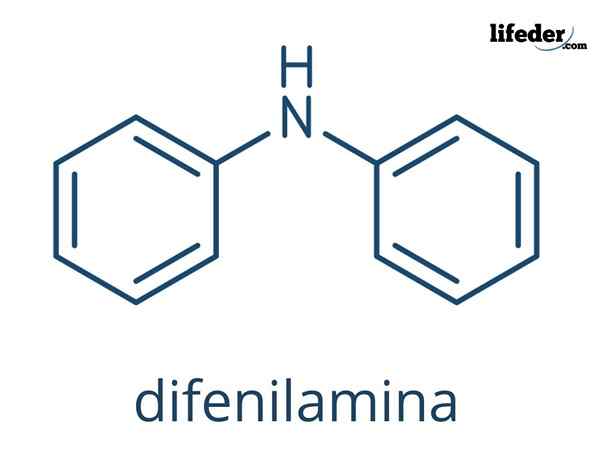
De Difenylamine Het is een organische verbinding waarvan de chemische formule is (c6H5))2NH. De naam geeft aan dat het een amine is, evenals zijn formule (-nh2)). Aan de andere kant verwijst de term "diffenil" naar de aanwezigheid van twee aromatische ringen gekoppeld aan stikstof. Bijgevolg is defilamine een aromatische amine.
Binnen de wereld van organische verbindingen is het aromatische woord niet noodzakelijkerwijs verband.

In het geval van difenylamine, valt de aromaticiteit en het feit dat hun vaste stof een onderscheidend aroma presenteert samen. De basis of mechanismen die zijn chemische reacties regelen, kunnen echter worden verklaard door zijn aromatische karakter, maar niet vanwege het aangename aroma.
De chemische structuur, basiciteit, aromaticiteit en intermoleculaire interacties zijn de variabelen die verantwoordelijk zijn voor zijn eigenschappen: van de kleur van zijn kristallen tot zijn toepasbaarheid als antioxidantmiddel.
Chemische structuur van defilamine

In de superieure afbeeldingen worden de chemische structuren van het diffenilamine weergegeven. De zwarte bollen komen overeen met koolstofatomen, wit tot waterstofatomen en blauw met het stikstofatoom.
Het verschil tussen beide afbeeldingen is het model van hoe ze het molecuul grafisch vertegenwoordigen. In de lagere benadrukt het de aromaticiteit van de ringen met de lijnen die in het zwart zijn bezaaid en ook de vlakke geometrie van deze ringen wordt bewezen.
Geen van de twee afbeeldingen toont het solitaire paar elektronen dat niet op het stikstofatoom wordt gedeeld. Deze elektronen "lopen" door het geconjugeerde π -systeem van de dubbele bindingen in de ringen. Dit systeem vormt een soort circulerende wolk die intermoleculaire interacties mogelijk maakt; dat wil zeggen met andere ringen van een ander molecuul.
Het kan u van dienst zijn: Laboratoriumthermometer: kenmerken, waarvoor is het, gebruik, voorbeeldenHet bovenstaande betekent dat het niet -afgeschermde stikstofkoppel door beide ringen loopt, in deze elektronische dichtheid verdeelt, en dan keren ze terug naar stikstof, om de cyclus opnieuw te herhalen.
In dit proces neemt de beschikbaarheid van deze elektronen af, wat resulteert in een afname van de basiciteit van de dipelamine (de neiging om elektronen als een Lewis -basis te doneren).
Dipenylamine -gebruik/toepassingen
Difenylamine is een oxidatiemiddel dat in staat is om een reeks functies te vervullen, en onder hen zijn de volgende:
- Tijdens hun opslag ervaren appels en peren een fysiologisch proces genaamd brandend, gerelateerd aan de productie van geconjugeerde trienos, wat leidt tot huidschade van fruit. Dipenylamine -werking maakt het mogelijk om de opslagperiode te verhogen, waardoor fruitschade wordt verminderd tot 10 % van wat er in hun afwezigheid wordt waargenomen.
- Bij het bestrijden van oxidatie breiden difenylamine en zijn derivaten het functioneren van motoren uit door de verdikking van gebruikte olie te vermijden.
- Difenylamine wordt gebruikt om ozonactie bij rubberproductie te beperken.
- Difenylamine wordt gebruikt in analytische chemie voor nitraatdetectie (nee3-), Chlorates (clo3-) en andere oxiderende middelen.
- Het is een indicator die wordt gebruikt in nitraatvergiftiging detectietests.
- Wanneer het RNA een uur wordt gehydrolyseerd, reageert het met de defilamine; Dit maakt zijn kwantificering mogelijk.
- In de diergeneeskunde wordt dip -pilamine topisch gebruikt bij de preventie en behandeling van de manifestaties van de boreride -worm bij fokdieren.
- Sommige van de duelamine-derivaten behoren tot de categorie niet-steroïde ontstekingsremmende geneesmiddelen. Ze kunnen ook farmacologische en therapeutische effecten hebben, zoals antimicrobiële, analgetica, anticonvulsiva en anti -kankeractiviteit.
Dipenylamine -voorbereiding
Natuurlijk wordt de defilamine geproduceerd in de ui, in de korianders, in de bladeren van groene en zwarte thee, en in de schelpen van de citrusvruchten. Synthetisch zijn er veel routes die tot deze verbinding leiden, zoals:
Thermische deaminatie van aniline
Het wordt bereid door thermische deaminatie van aniline (C6H5NH2) In aanwezigheid van oxiderende katalysatoren.
Als aniline in deze reactie geen zuurstofatoom in zijn structuur bevat, waarom oxideer je dan? Omdat de aromatische ring een elektronenaantrekkersgroep is, in tegenstelling tot het H -atoom, dat zijn lage elektronische stikstofdichtheid in de molecuul schenkt.
2 c6H5NH2 => (C5H5))2 NH+NH3
Ook kan aniline reageren met anilinehydrochloridezout (C6H5NH3+Klet-) onder een verwarming van 230 ºC gedurende twintig uur.
C6H5NH2 + C6H5NH3+Klet- => (C5H5))2 NH
Fenotiazine -reactie
Dipenylamine ontstaat verschillende afgeleid in combinatie met verschillende reagentia. Een van deze is fenotië, die synthetiseren met zwavel een voorloper is van derivaten met farmaceutische actie.
(C6H5))2NH +2S => S (C6H4) NH +H2S

Dipenylamine -eigenschappen
Dipenylamine is een witte kristallijne vaste stof die, afhankelijk van de onzuiverheden, bronchneale, barnsteen- of gele tonen kan verwerven. Het heeft een aangenaam bloemaroma, het heeft een molecuulgewicht 169,23 g/mol en een dichtheid van 1,2 g/ml.
De moleculen van deze vaste stoffen interageren door van der Waals-krachten, waaronder waterstofbruggen gevormd door stikstofatomen (NH-NH) en het stapelen van aromatische ringen, die hun "elektronische wolken" rusten op de andere.
Kan u van dienst zijn: zinksulfide (ZnS)Terwijl aromatische ringen veel bezetten. Het bovenstaande zorgt ervoor dat de vaste stof geen zeer hoog fusiepunt heeft (53 ºC).
In vloeibare toestand zijn de moleculen echter meer gescheiden en verbetert de effectiviteit van waterstofbruggen. Evenzo is de defilamine relatief zwaar en heeft veel warmte nodig om naar een gasfase te gaan (302 ºC, het kookpunt). Dit is ook gedeeltelijk te wijten aan het gewicht en de interacties van de aromatische ringen.
Oplosbaarheid en basiciteit
Het is zeer onoplosbaar in water (0,03 g/100 g water) vanwege het hydrofobe karakter van zijn aromatische ringen. In plaats daarvan is het erg oplosbaar in organische oplosmiddelen zoals benzeen, koolstoftetrachloride (CCL4), aceton, ethanol, pyridine, azijnzuur, enz.
De zuurgraadconstante (PKA) is 0,79, wat verwijst naar de zuurgraad van zijn geconjugeerde zuur (C6H5NH3+)). Het proton dat aan stikstof is toegevoegd, heeft de neiging om afstand te doen, omdat het paar elektronen waarmee het is gekoppeld door de aromatische ringen kan lopen. Dus hoge instabiliteit C6H5NH3+ Het weerspiegelt de lage basiciteit van diffenilamine.
Referenties
- De Lubrizol Corporation. (2018). Difenylamine antioxidanten. Hersteld van lubrizol.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Farmacologische toepassingen van difenylamine en zijn afgeleide als krachtige bioactieve verbinding: een overzicht. Stroom bioactieve verbindingen, volume 13.
- Prepchem. (2015-2016). Bereiding van difenylamine. Hersteld van prapchem.com
- Pubchem. (2018). Difenylamine. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Wikipedia. (2018). Difenylamine. Opgehaald van.Wikipedia.borg

