Kalium permanganaat (kmno4)

- 1165
- 308
- Glen Armstrong
 Kaliumpermanganaatkristallen
Kaliumpermanganaatkristallen Wat is kaliumpermanganaat?
Hij kaliumpermanganaat (Kmno4) Het is een anorganische verbinding gevormd door mangaan -transitie -metaal van groep 7 (VIIB) -, zuurstof en kalium. Het is een donkerpaarse glasachtige vaste stof. Zijn waterige oplossingen zijn ook donkerpaars; Deze oplossingen worden minder violet omdat ze in grote hoeveelheden water worden verdund.
Commercieel wordt bereikt in presentaties van tabletten, kristallen en stof. Het is bekend met de namen van Condy of Mineral Camaleón. De term "kameleon" verwijst naar het vermogen van het mineraal: als het van kleur verandert in contact met bijtende frisdrank en organische stof, treedt suiker op.
De kmno4 Het begint in de volgende volgorde reducties (winst elektronen) te lijden in een opeenvolging van kleuren: paars> blauw> groen> geel> kleurloos (met bruin bruin mno2)). Deze reactie toont een belangrijke eigenschap van kaliumpermanganaat: het is een zeer sterk oxidatiemiddel.
Formule
De chemische formule is kmno4; dat wil zeggen voor elk kation k+ Er is een anion mno4- Interactie hiermee
Chemische structuur van kaliumpermanganaat
 Kristallijne structuur van kmno4
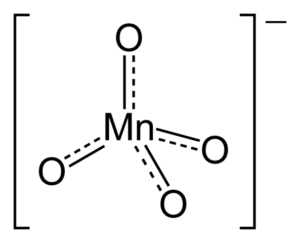
Kristallijne structuur van kmno4 In het bovenste beeld wordt de kristallijne structuur van de kmno weergegeven4, dat is ortorrombisch type. Paarse bollen komen overeen met K -kationen+, Terwijl de tetraëder wordt gevormd door de vier rode bollen en de blauwachtige bol overeenkomt met het anion mno4-.
Waarom heeft anion een tetraëdrische geometrie? Zijn Lewis -structuur beantwoordt deze vraag. De stippellijnen betekenen dat de dubbele links resoneren tussen de Mn en de O. Om deze structuur aan te nemen, moet het metaalcentrum een hybridisatie hebben SP3.

Omdat mangaan ongebruikelijke elektronenparen mist, worden Mn-O-bindingen niet naar hetzelfde vlak geduwd. Evenzo wordt de negatieve belasting verdeeld over de vier zuurstofatomen, die verantwoordelijk is voor de oriëntatie van kations+ Binnen kristallijne opstellingen.
Kan u van dienst zijn: ionisatieconstanteKmno gebruikt4
Geneeskunde en veterinair
Vanwege zijn bactericide werking wordt het gebruikt bij tal van ziekten en aandoeningen die huidlaesies veroorzaken, zoals: voetinfecties met schimmels, impetigo, oppervlakkige wonden, dermatitis en tropische zweren.
Vanwege de schadelijke werking moet kaliumpermanganaat worden gebruikt bij lage concentraties (1: 10000), wat de effectiviteit van zijn werking beperkt.
Het wordt ook gebruikt bij de behandeling van visparasitose in aquaria die infecties produceren van huidliggen en zweren.
Water behandeling
Het is een chemische regeneratie die wordt gebruikt om ijzer, magnesium en waterstofsulfide uit het water te verwijderen (van een onaangename geur), kunnen gebruiken om het afvalwater te zuiveren.
IJzer en magnesium neerslaan in de vorm van zijn onoplosbare wateroxiden. Bovendien helpt het om de roest in de pijpen te verwijderen.
Fruitbehoud
Kaliumpermanganaat verwijdert het ethyleen dat in de bananen wordt gegenereerd tijdens opslag, waardoor het meer dan 4 weken kan blijven zonder te rijpen, ook bij kamertemperatuur.
In Afrika gebruiken ze het om groenten te laten weken, met als doel het neutraliseren en elimineren van een huidige bacteriemiddel.
Vuuractie
Kaliumpermanganaat wordt gebruikt om de brandverlenging te beperken. Gebaseerd op het vermogen van het permanganaat om brand te starten, wordt het gebruikt om tegenstromen in bosbranden te creëren.
Redox -titel
In analytische chemie worden de gestandaardiseerde waterige oplossingen gebruikt als een oxidant -titel in redox -bepalingen.
Organisch reagens
Het dient om alkenen om te zetten in dioles; dat wil zeggen, twee OH -groepen worden toegevoegd aan de dubbele binding c = c. De volgende chemische vergelijking:

Ook in zwavelzuuroplossing met chroomzuur (h2Cro4) Het wordt gebruikt voor de oxidatie van primaire alcoholen (R-OH) tot carbonzuren (R-COOH of RCO2H).
Kan u van dienst zijn: niet -polaire covalente bindingHet oxiderende vermogen ervan is sterk genoeg om de primaire of secundaire alkylgroepen van de aromatische verbindingen te oxideren "carboxylen ze"; dat wil zeggen, transformeren van de zijketen R (bijvoorbeeld een cho3) In een COOH -groep.
Historisch gebruik
Het maakte deel uit van de poeders die werden gebruikt als flits in fotografie of om de termietreactie te starten.
Het werd in de Tweede Wereldoorlog gebruikt voor de camouflage van witte paarden gedurende de dag. Hiervoor gebruikten ze mangaandioxide (Mno2), die bruin is; Op deze manier bleven ze onopgemerkt.
Kmno -synthese4
Het pyrolusiet -mineraal bevat mangaandioxide (MnO2) en kaliumcarbonaat (caco3)).
In 1659 de chemicus Johann R. Glauber smolt het mineraal en loste het op in water, waarbij het uiterlijk van een groene kleuring in de oplossing werd waargenomen, die later veranderde in violette kleur en uiteindelijk in rood. Deze laatste kleur kwam overeen met het genereren van kaliumpermanganaat.
In het midden van de Nineteenth Century zocht Henry Condy een antiseptisch product en behandelde aanvankelijk de pyrolusiet met NaOH en later met KOH, waardoor de zo -aangedane condykristallen produceerden; dat wil zeggen kaliumpermanganaat.
Kaliumpermanganaat wordt industrieel geproduceerd door mangaandioxide aanwezig in het pyrolusiet -mineraal. De MNO2 aanwezig in het mineraal reageert met kaliumhydroxide en wordt vervolgens verwarmd in aanwezigheid van zuurstof.
2 MNO2 + 4 KOH +of2 => 2 K2MNE4 + 2 H2OF
Kaliummanganaat (k2MNE4) wordt omgezet in kaliumpermanganaat door elektrolytische oxidatie in een alkalisch medium.
2 k2MNE4 + 2 H2O => 2 kmno4 + 2 KOH +H2
In een andere reactie om kaliumpermanganaat te produceren, wordt kaliummanganaat gereageerd met CO2, Het onevenredigheidsproces versnellen:
3 k2MNE4 + 2 CO2 => 2 kmno4 + MNE2 + K2CO3
Kan u van dienst zijn: moleculaire orbitale theorieVanwege het genereren van de MNO2 (Mangaan -dioxide) Het proces is ongunstig, KOH moet worden gegenereerd uit k2CO3.
Eigenschappen van Kmno4
Het is een paarse kristallijne vaste stof die smelt bij 240 ºC, die een dichtheid van 2,7 g/ml heeft en een molecuulgewicht van ongeveer 158 g/mol.
Het is niet erg oplosbaar in water (6,4 g/100 ml bij 20 ºC), wat aangeeft dat watermoleculen de MNO -ionen niet grotendeels oplossen4-, Omdat misschien hun tetraëdrische geometrieën veel water vereisen voor hun oplossing. Evenzo kan het ook oplossen in methylalcohol, aceton, azijnzuur en pyridine.
Ontleding
Het ontleedt bij 240 ºC, waardoor zuurstof wordt vrijgelaten:
2 kmno4 => K2MNE4 + MNE2 + OF2
U kunt ontleding ervaren door de werking van alcohol en andere organische oplosmiddelen, evenals door de werking van sterke zuren en reductiemiddelen.
Oxiderende kracht
In dit zout vertoont het mangaan de grootste staat van oxidatie (+7), of wat hetzelfde is, tot de maximale hoeveelheid elektronen die het op ionische manier kan verliezen. Op zijn beurt is de elektronische mangaanconfiguratie 3D54S2; Daarom is in kaliumpermanganaat de gehele Valencia -laag van het mangaanatoom "leeg".
Vervolgens presenteert het mangaanatoom de natuurlijke neiging om elektronen te winnen; dat wil zeggen, om te worden gereduceerd tot andere oxidatietoestanden in alkalische of zure media. Dit is de verklaring waarom kmno4 Het is een krachtig oxidatiemiddel.
Referenties
- F.Albert Cotton en Geoffrey Wilkinson, FRS. (1980). Geavanceerde anorganische chemie. Redactionele Limusa, Mexico, 2e editie, pagina 437-452.
- Robin Wasserman. Medisch gebruik voor kaliumpermanganaat. Livestrong hersteld.com
- Clark D. Het 3 ultieme gebruik van kaliumpermanganaat. Hersteld van technologie.borg
- J.M. Cedardea, c. Arnáiz en E. Díaz. Kalium permanganaat: een krachtig en veelzijdig oxidatiemiddel. Uiteenzetting. Chemische en milieutechniek. Universiteitsschool van Sevilla.

