Aluminiumchloride (ALCL3)

- 1969
- 393
- Glen Armstrong
 Formule en structuur van aluminiumchloride
Formule en structuur van aluminiumchloride Wat is aluminiumchloride?
Hij aluminiumchloride Het is een anorganische chemische verbinding waarvan de formule alcl is3. Het wordt gepresenteerd als een vast of wit stof, hoewel het vanwege een verontreiniging met ijzerchloride en vocht geel kan worden. Het bestaat uit een Lewis -zuur, maar onder bepaalde omstandigheden gedraagt het zich ook als een Lewis -basis.
Ondanks aluminium als metaal in het periodiek systeem, is er een covalente binding tussen aluminium en chloor om aluminiumchloride te vormen.
Deze covalente binding kan verklaren waarom gesmolten aluminiumchloride een slechte geleider van elektriciteit is; Terwijl de gesmolten zouten van andere verbindingen, zoals natriumchloride, goede elektriciteitsgeleiders zijn.
Aluminiumchloride wordt geproduceerd door een exotherme reactie tussen aluminium en chloor, of waterstofchloride, bij een temperatuur tussen 650 en 750 ºC.
Aluminiumchloride wordt gebruikt als een antitranspirant en om overmatig zweten te bestrijden. Een van de derivaten wordt gebruikt als een stollingsmiddel bij de behandeling van industrieel afvalwater en wordt ook gebruikt als de belangrijkste katalysator in de chemische reacties van de industrie.
Aluminiumchloridestructuur
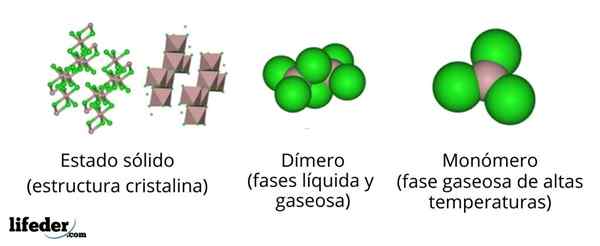
In het bovenste beeld hebben we verschillende representaties voor elk van de kristallijne of moleculaire structuren die het watervrij aluminiumchloride vertonen, alcl3, In verschillende van zijn fysieke staten.
De alcl3 vaste stof bestaat uit een monokliene kristallijne structuur gevormd door lagen octaedros gecoördineerd met elkaar. In deze octaëder (bruine kleur), het ionen3+ Het wordt gecoördineerd met zes clionen-, Handelende chloriden als bruggen tussen twee octaëderra.
Wanneer de temperatuur stijgt en de alll is opgericht3, De lagen worden gescheiden in eenheden van de2Klet6 (Afbeeldingscentrum). Nu vormt het aluminiumatoom links met drie chlooratomen en een link met het andere aluminiumatoom: CL:3Al-alcl3. Deze dimeren verklaren waarom de ALCL3 gesmolten is minder dicht dan zijn kristallen.
Kan u van dienst zijn: gadolinio: structuur, eigenschappen, verkrijgen, gebruikIn de stoomfase, de dimeren naar de2Klet6 Ze distantiëren elkaar. Maar als deze stoom wordt onderworpen aan hoge temperaturen, dissocieert de dimeer in moleculaire eenheden ALCL3, waarin het aluminiumatoom drie banden vormt met chlooratomen. De alcl3 presenteert een trigonale platte geometrie.
Aluminiumchloride -eigenschappen
 Vast monster van aluminiumchloride met geelachtige tonen. Bron: Xlollitox, CC door 3.0, via Wikimedia Commons
Vast monster van aluminiumchloride met geelachtige tonen. Bron: Xlollitox, CC door 3.0, via Wikimedia Commons Formules
Alcl3 (watervrij)
Alcl3· 6h2O (hexahydraat)
Molaire massa
133.34 g/mol (anhydro)
241.43 g/mol (hexahydraat)
Fysiek uiterlijk
Kristallijn vast of wit stof. Het kan een geelachtige tint worden als gevolg van besmetting met ijzerchloride. U kunt ook veranderen in een grijsachtige kleur voor vocht.
Smeltpunt
192.4 ºC
Kookpunt
Sublima bij 178 ºC, dus het is niet eenvoudig om het kookpunt van aluminiumchloride te verkrijgen.
Dikte
2.48 g/cm3 (watervrij)
2.398 g/cm3 (Hexahydraat)
Oplosbaarheid in water
439 g/l A 0 ºC
458 g/l bij 20 ºC
466 g/l A 30 ºC
Aluminiumchloride is een hygroscopische verbinding die nat luchtwater kan absorberen, waardoor een rook wordt uitgezonden tijdens het proces.
Oplosbaarheid in andere oplosmiddelen
Ethanol oplosbaar, chloroform, koolstoftetrachloride, benzofenon en nitrobenzeen. Enigszins oplosbaar in benzeen.
Dampdruk
13.3 kPa bij 151 ºC (0.131 ATM).
Smurrie
0.35 CP tot 197 ºC
Reactiviteit
Aluminiumchloride is een amfotaatsubstantie, dat wil zeggen dat het zich gedraagt als een zuur of een basis. De werking ervan als zuur is echter overwegend, omdat aluminiumchloride wordt gebruikt als een Lewis -zuur en tegelijkertijd een katalysator is in veel chemische reacties; Onder hen, de reactie van Friedel-Crafts.
Kan u van dienst zijn: neodymium: structuur, eigenschappen, gebruikZelfs aluminiumchloride wordt geclassificeerd als een zuur, in plaats van het als een zout te doen.
Watervrij aluminiumchloride in waterige oplossing wordt omgezet in hexahydraatzout (alcl3· 6h2O), die niet door opwarming terugkeert naar de watervrije vorm.
Aluminiumatomen van twee ALCL -moleculen3 Ze interageren met elkaar om 8 elektronen in hun valentielaag te voltooien, wat resulteert in de vorming van het dimeer aan de2Klet6. Dit dimeer is aanwezig in gesmolten aluminiumchloride en stoom.
Aluminiumchloride reageert met natriumhydroxide om aluminiumhydroxide te vormen, een gelatineus neerslag:
Alcl3 + NaOH → AL (OH)3 + 3 NaCl
Aluminium chloridetoepassingen
Antitranspirant en antihemorragisch
 Aluminiumchloride maakt deel uit van de ingrediënten die worden gebruikt in de formuleringen van verschillende deodorants. Bron: Th145, CC BY-SA 2.0, via Wikimedia Commons
Aluminiumchloride maakt deel uit van de ingrediënten die worden gebruikt in de formuleringen van verschillende deodorants. Bron: Th145, CC BY-SA 2.0, via Wikimedia Commons Aluminiumchloride wordt gebruikt als een antitranspirant bij persoonlijke deodorants en wordt ook gebruikt om overmatig zweten te beheersen (hyperhidrose). Het wordt ook gebruikt in formuleringen om kleine bloedingen te regelen, zoals die gepresenteerd in tandheelkundige behandelingen.
Rioleringsbehandeling
Aluminiumchloride in de vorm van PAC (polyaluminechloride) wordt gebruikt als coagulant bij de behandeling van industrieel afvalwater, vanwege het vermogen om water en uitdrogen slib te verduidelijken.
Katalysator
Aluminiumchloride is een van de belangrijkste katalysatoren die in de industrie worden gebruikt en fungeren als een katalysator in tal van reacties, waaronder Friedel-Crafts.
Kan u van dienst zijn: europium: structuur, eigenschappen, verkrijgen, gebruikAluminiumchloride katalyseert de bereidingsreacties van antraquinonen, waarvan sommige in de textielindustrie worden gebruikt. Er zijn ook antraquinonen met antibacteriële, antiparasitaire, fungicide en antivirale eigenschappen.
Aluminiumchloride katalyseert de reacties geproduceerd door dodecilbenzeen, gebruikt bij de productie van wasmiddelen en ethylbenzeen, verbinding gebruikt bij de productie van polystyreen, polymeer gebruikt bij de uitwerking van kunststoffen, harsen en rubber.
Aluminiumchloride wordt ook gebruikt als katalysator in een reactie die deel uitmaakt van de productie van benzine met een hoog octaan. Evenzo katalyseert het oliecrackingproces.
Risico's
Aluminiumchloride is een corrosieve stof en het contact kan irritatie en huid- en oogletsel veroorzaken, waardoor oogschade wordt veroorzaakt.
Bij het oplossen in het water kunnen giftige gassen worden vrijgegeven, zoals waterstofchloride; gassen die in staat zijn om een irritatie van de neus en keel te inademen, waardoor er zware en longirritatie kunnen worden veroorzaakt. Deze irritatie kan leiden tot de accumulatie van vloeistof in de longen (longoedeem), die eindigt in een medisch noodgeval.
Het heeft geprobeerd een verband te leggen tussen de ziekte van Alzheimer en aluminiumchloride; Hoewel de onderzoeksresultaten niet overtuigend zijn.
Evenzo is het verband tussen het gebruik van deodorants die ze gebruiken als anti -transpirant tegen de Alll onderzocht3 en borstkanker. Onderzoek is niet in staat geweest om een overtuigende relatie aan te tonen. In elk geval blokkeert aluminiumchloride de werking van een natuurlijk ontgiftingssysteem van het organisme en warmteemissie, zoals zweet.
Referenties
- Wikipedia. (2021). Chloride -aluminium. Opgehaald uit: in.Wikipedia.borg
- National Center for Biotechnology Information (2021). Chloride -aluminium, PubChem Compound Samenvatting voor CID 24012. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- NJ Health. (2008). Hazardoous Substance Fact Sheet: aluminiumchloride. [PDF]. Hersteld van: nj.Gov
- Britannica Encyclopaedia. (2021). Chloride -aluminium. Hersteld van: Britannica.com
- Elsevier B.V. (2021). Anthrachinones. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- John P. Cunha. (02 mei 2020). Actueel chloride -aluminium. Hersteld van: rxlist.com

