Cysteïne -kenmerken, structuur, functies, biosynthese
- 4233
- 654
- Hugo Crooks
De Cysteïne ((Cys, c) is een van de 22 aminozuren die in de natuur worden gevonden als onderdeel van de polypeptideketens die de eiwitten van levende wezens vormen. Het is essentieel voor de stabiliteit van de tertiaire structuren van eiwitten, omdat het de vorming van intramoleculaire disulfidebruggen helpt.
Evenals het geldt voor andere aminozuren zoals alanine, arginine, asparagine, glutamaat en glutamine, glycine, proline, serine en tyrosine, mensen kunnen cysteïne synthetiseren, dus dit wordt niet beschouwd als een essentieel aminozuur.
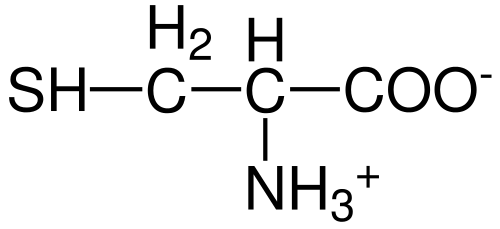
 Cysteïne aminozuurstructuur (bron: hattrich [public domein] via Wikimedia Commons)
Cysteïne aminozuurstructuur (bron: hattrich [public domein] via Wikimedia Commons) Desondanks, en gezien het feit dat synthesesnelheden niet altijd de lichaamsvereisten leveren, beschrijven sommige auteurs cysteïne als een "voorwaardelijk" in wezen "aminozuur.
Dit aminozuur werd genoemd door de "cystina", een component van de vesiculaire berekeningen ontdekt in 1810, waarvan de naam in 1832 werd bedacht door een. Baudrimont en F. Malaguti. Een paar jaar later, in 1884, en. Baumann ontdekte dat cysteïne het product was van cystine -reductie.
Na het werk van Bauman, in 1899, werd vastgesteld dat cysteïne het hoofdbestanddeel is van het eiwit dat de hoorns van verschillende dieren vormt, wat het mogelijke gebruik ervan voor polypeptidesynthese vormt.
Momenteel is het bekend dat cysteïne van het lichaam uit voedsel, eiwitrecycling en endogene synthese komt, die voornamelijk in hepatocyten voorkomt.
[TOC]
Kenmerken
Cysteïne heeft een molecuulgewicht van 121.16 g/mol en wordt gevonden, samen met leucine, isoleucine, valine, fenylalanine, tryptofaan, methionine en tyrosine, van de meest hydrofobe aminozuren.
Het behoort tot de groep polaire aminozuren zonder belasting en kan, net als andere aminozuren, worden afgebroken door alkalische hydrolyse bij hoge temperaturen.
Net als tryptofaan, serine, glycine en tronine, is cysteïne een metabole voorloper voor gluconeogenese en ketogenese (vorming van ketonlichamen).
Dit aminozuur bestaat als onderdeel van de peptidesequentie van eiwitten, maar kan ook vrij zijn in bloedplasma als homogene disulfiden (cystine, een derivaat) of gemengd, samengesteld uit de homocysteïne-cysteïne-vorm.
Het belangrijkste verschil tussen vrije cysteïne en het verschil in de eiwitstructuur is dat de eerste zich in een zeer roestig redox -toestand bevindt, terwijl de laatste meestal behoorlijk is verminderd.
Structuur
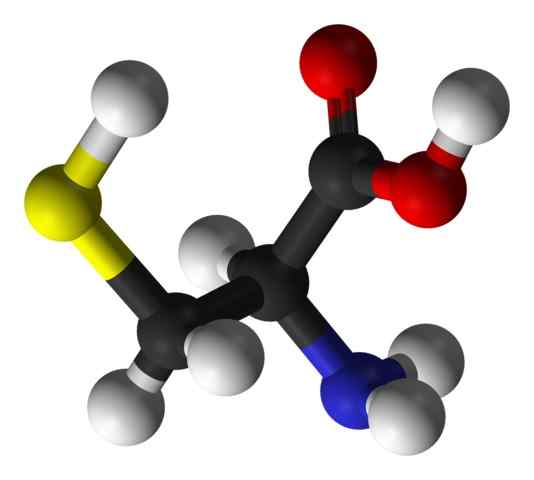
Net als bij de rest van de tot nu toe beschreven aminozuren, heeft de cysteïne een centraal koolstofatoom, dat chiraal is en bekend staat als koolstof α.
Vier verschillende chemische soorten zijn verbonden met dit koolstofatoom:
- Een aminogroep (-nh3+)
- Een carboxylgroep (-co-)
- een waterstofatoom en
- Een substituent (-r).
De substituerende groep is degene die identiteit geeft aan elk aminozuur en die van de cysteïne wordt gekenmerkt door een zwavelatoom te bevatten als onderdeel van een groep Tiol of Sulfhydrillo (-CH2-sh).

Het is deze groep waarmee het kan deelnemen aan de vorming van intra-terminoleculaire disulfidebruggen. Omdat het een nucleofiel is, kunt u ook deelnemen aan substitutiereacties.
In feite kan deze zijketen van de cysteïne worden gemodificeerd voor de vorming van twee verbindingen die bekend staan als "selenocysteïne" en "lantionine". De eerste is een aminozuur dat ook deelneemt aan eiwitvorming en de tweede is een niet -eiwit aminozuurderivaat.
Kan u dienen: histonen: kenmerken, structuur, typen en functiesDe cysteïne tiolgroep wordt ook gekenmerkt door zijn grote affiniteit met zilver- en kwikionen (Ag+ en Hg2+).
Functie
De belangrijkste functies van cysteïne in levende organismen hebben te maken met hun deelname aan eiwitvorming. In het bijzonder neemt cysteïne deel aan de oprichting van disulfidebruggen, die essentieel zijn voor de vorming van tertiaire eiwitstructuur.
Bovendien is dit aminozuur niet alleen nuttig voor eiwitsynthese, maar neemt ze ook deel aan de synthese van glutathion (GSH) en biedt verminderde zwavel voor methionine, lipoïnezuur, thiamine, co -enzyme A (CoA), molybdopterine (een cofactor) en andere Verbindingen met biologisch belang.
Onder omstandigheden van overmatige hoeveelheid gesulfuriseerde aminozuren kunnen cysteïne en andere gerelateerde aminozuren worden gebruikt voor de productie van anorganisch pyruvaat en zwavel. Pyruvate slaagt erin om te worden omgeleid naar de gluconeogene route, die dient voor glucoseproductie.
De keratines, een van de meest voorkomende soorten structurele eiwitten in het dierenrijk, zijn rijk aan cysteïneresten. Schapenwol bevat bijvoorbeeld meer dan 4% zwavel uit dit aminozuur.
Cysteïne neemt ook deel aan vele oxide-reductiereacties, dus het maakt deel uit van de actieve plaats van sommige enzymen.
Bij het reageren met glucose genereert dit aminozuur reactieproducten die aantrekkelijke smaken en aroma's introduceren in sommige culinaire preparaten.
Biosynthese
De biosynthese van aminozuren in het menselijk lichaam en in die van andere dieren (zoogdieren en niet-zoogdieren) vindt plaats in een weefselvorm en celklasse; Het is een proces dat energie verdient en meestal wordt gescheiden tussen verschillende organen.
De lever is een van de belangrijkste organen die betrokken zijn bij de synthese van de meeste niet -essentiële aminozuren, ongeacht de beschouwde soort.
Hierin wordt niet alleen de cysteïne gesynthetiseerd, maar ook aspartaat, asparagine, glutamaat en glutamine, glycine, serine, tyrosine en anderen van zijn specifieke aminozuurvoorlopers.
In 1935 heeft het merk Erwin vastgesteld dat cysteïne, bij zoogdieren, van nature wordt gesynthetiseerd uit methionine, dat uitsluitend in leverweefsel plaatsvindt.
Dit proces kan optreden als gevolg van een "transmetiel" methionine, waarbij methylgroepen worden overgebracht naar heuvel en creatine. Cysteïne kan echter ook worden gevormd uit metionine dankzij een transulfuratie.
Vervolgens werd aangetoond dat, naast metionine, sommige synthetische verbindingen zoals N-acetylcysteïne, cysteamine en cystamine, nuttige voorlopers zijn voor cysteïnsynthese.
In het geval van de N-acetylcysteïne wordt dit genomen door de cellen, waar het wordt omgezet in cysteïne door een enzym van de cytosol in de cytosol.
Synthesemechanisme
Het synthese -mechanisme van cysteïne uit het bekendste methodine is dat van trans -uloo. Dit gebeurt voornamelijk in de lever, maar het is ook bepaald in de darm en alvleesklier.
Dit gebeurt uit homocysteïne, een verbinding afgeleid van aminozuurmethodine; En de eerste reactie van deze biosynthetische route is een condensatie gekatalyseerd door het β-sentase (CBS) cistationine enzym (CBS).
Kan u dienen: uracil: structuur, functies, eigenschappen, syntheseDit enzym vertegenwoordigt de doorgang van "inzet" van de route en condenseert een homocysteïne met een serineresten, een ander eiwitaminozuur, dat cystationine produceert. Vervolgens wordt deze verbinding "gesneden" of "gesplitst" door het cistationasa -enzym, wat leidt tot de afgifte van cysteïne.
De regulatie van CBS -enzymatische activiteit wordt gemedieerd door de beschikbaarheid van methodine en door de redox -toestand van de cel waar dit proces plaatsvindt.
Via de cysteïnesyntheseroute kunnen cellen overtollig methodine aan, omdat hun conversie naar cysteïne een onomkeerbaar proces is.
Cysteïnesynthese in planten en micro -organismen
In deze organismen wordt de cysteïne voornamelijk gesynthetiseerd uit anorganische zwavel, wat de meest voorkomende bron van bruikbare zwavel is in de aerobe biosfeer.
Dit wordt genomen, komt de cellen binnen en wordt vervolgens gereduceerd tot sulfide (S2-), die op een vergelijkbare manier in de cysteïne is opgenomen als wat er met ammonium gebeurt in de synthese van glutamaat of glutamine.
Metabolisme en afbraak
Katabolisme cysteïne komt voornamelijk voor in levercellen (hepatocyten), hoewel het ook kan optreden in andere soorten cellen zoals neuronen, endotheelcellen en gladde spiercellen van lichaamsvasculatuur.
Bepaalde defecten in het katabolisme van de cysteïne produceren een erfelijke ziekte die bekend staat als de "cystinurie", gekenmerkt door de aanwezigheid van cystineberekeningen in de nieren, blaas en ureter.
De cystine is een aminozuur afgeleid van de cysteïne en de berekeningen worden gevormd door de vereniging van twee moleculen door hun zwavelatomen.
Een deel van het metabolisme van cysteïne resulteert in de vorming van wetenschappelijk zuur, waaruit stierenvechten, een niet-proteïstisch aminozuur wordt gevormd. De reactie wordt gekatalyseerd door het dioxigenasa -cysteïne -enzym.
Bovendien kan de cysteïne door de formaldehyde worden geoxideerd om N-formil cysteïne te produceren, waarvan de daaropvolgende verwerking kan leiden tot de vorming van "merchandise" (product van de condensatie van cysteïnen met aromatische verbindingen).
Bij dieren wordt ook cysteïne gebruikt, evenals glutamaat en glutamine, voor de synthese van co -enzym A, glutathion (GSH), pyruvaat, sulfaat en sulfiderzuur.
Een van de methoden voor conversie van cysteïne naar pyruvaat vindt plaats in twee stappen: de eerste impliceert de verwijdering van het zwavelatoom en de tweede een transaminatiereactie.
De nieren zijn verantwoordelijk voor de uitscheiding van sulfaten en sulfieten afgeleid van het metabolisme van zwavelverbindingen zoals cysteïne, terwijl longen zwaveldioxide en sulfidrinezuur uitademen.
Glutathion
Glutathione, een molecuul gevormd door drie aminozuurafval (glycine, glutamaat en cysteïne) is een molecuul dat aanwezig is in planten, dieren en bacteriën.
Het heeft speciale eigenschappen die het een uitstekende redox "buffer" maken, omdat het cellen beschermt tegen verschillende soorten oxidatieve stress.
Voedsel rijk aan cysteïne
Cysteïne wordt van nature aangetroffen in voedingsmiddelen dat zwavel bevat als de dooiers (geel) van eieren, rode paprika's, knoflook, uien, broccoli, bloemkool, colliflower, kekkjes en Brussels -cholen, waterclakes en mosterdbladeren.
Het is ook meestal aanwezig in eiwitrijke voedingsmiddelen zoals vlees, peulvruchten en zuivelproducten, waaronder:
Kan u van dienst zijn: ovalbumin: structuur, functies, denaturatie- Koeienvlees, varkensvlees, kip en vis
- Haver en linzen
- Zonnebloemzaden
- Yoghurt en kaas
Voordelen van cysteïne -inname
Er wordt aangenomen dat de inname haarverlies voorkomt en de groei ervan stimuleert. In de voedingsindustrie wordt het erg gebruikt als een in paniek massagemiddel en ook om de vleesachtige smaken te 'reproduceren'.
Andere auteurs hebben benadrukt dat de inname van voedingssupplementen of voedselrijke voedingsmiddelen afneemt.
Sommige voedingssupplementen gerelateerd aan cysteïne worden door mensen gebruikt als antioxidanten, die vanuit het oogpunt van de "vertraging" van veroudering als gunstig worden beschouwd.
De N-acetylcysteïne (een voorloper in de synthese van de cysteïne) wordt bijvoorbeeld beschouwd als een voedingssupplement, omdat dit resulteert in een toename van glutathionbiosynthese (GSH).
Gerelateerde ziekten
Er zijn enkele wetenschappelijke publicaties die hoge niveaus van plasma -cysteïne relateren met obesitas en andere gerelateerde pathologieën zoals hart- en vaatziekten en andere metaboole syndromen.
Cystinurie, zoals hierboven vermeld, is een pathologie die verband houdt met de aanwezigheid van cystinestenen, een zip -derivaat, vanwege een genetisch defect in de reabsorptie van de dibasische aminozuren zoals cystine.
Deficiëntiestoornissen
Cysteïnedeficiëntie is gerelateerd aan oxidatieve stress, omdat dit een van de belangrijkste voorlopers is voor glutathione synthese. Daarom kunnen tekortkomingen in dit aminozuur leiden tot voortijdige veroudering en alle flats die dit betekent.
Er is experimenteel aangetoond dat cysteïnesuppletie de functies van de skeletspier verbetert, de relatie tussen vet en niet -vette lichaamsmassa vermindert, vermindert de plasmaspiegels van inflammatoire cytokines, verbetert de functies van het immuunsysteem, enz.
In het midden van de jaren 1990 suggereerden sommige onderzoeken dat het syndroom van de verworven immunodeficiëntie (AIDS) een gevolg zou kunnen zijn van een door virus geïnduceerde cysteïnedeficiëntie.
Deze uitspraken werden ondersteund door het feit dat HI-positieve patiënten onderzocht.
Referenties
- Dröge, W. (1993). Cysteïne en glutathiontekort bij AIDS-patiënten: een reden voor behandeling met N-Aaceicyl-cysteïne. Farmacologie, 46, 61-65.
- Dröge, W. (2005). Oxidatieve stress en veroudering: veroudering van een cysteïnetekortsyndroom? Filosofische transacties van de Royal Society B: Biologische Wetenschappen, 360(1464), 2355-2372.
- Elshorbagy, een. K., Smith, a. D., Kozich, V., & Refsum, h. (2011). Cysteïne en obesitas. Obesitas, twintig(3), 1-9.
- Kridich, n. (2013). Biosynthese van cysteïne. Ecosal Plus, 1-30.
- McPherson, r. NAAR., & Hardy, g. (2011). Klinische en voedingsvoordelen van cysteïne-verrijkte eiwitsupplementen. Huidige mening in klinische voeding en metabole zorg, 14, 562-568.
- Mokhtari, v., Afsharian, p., Shahhoseini, m., Kalantar, s. M., & Moini, een. (2017). Een recensie over verschillende toepassingen van N-acetylcysteïne. Cell Journal, 19(1), 11-17.
- Piste, p. (2013). Cysteïne-master antioxidant. International Journal of Pharmaceutical, Chemical and Biological Sciences, 3(1), 143-149.
- Quig, D. (1998). Cysteïne -metabolisme en metaaldoxiciteit. Alternatieve geneeskunde Review, 3(4), 262-270.
- Wu, g. (2013). Amininozuren. Biochemie en voeding. Boca Raton, FL: Taylor & Francis Group.
- « Sociale leerkenmerken, Bandura -theorie, voorbeelden
- Socio -emotionele onderwijsdimensies, belang, kleuterschool »

