Yodhydric acid (hi) structuur, eigenschappen en gebruik

- 3241
- 987
- Lonnie Rohan
Hij Iarhydrinezuur Het is een waterige oplossing van waterstofjodide die wordt gekenmerkt door de hoge zuurgraad. Een definitie die meer verbonden is aan de chemische terminologie en de IUPAC, is dat het een hydrie is, wiens chemische formule hallo is.
Om het echter te onderscheiden van de gasvormige moleculen van waterstofjodide, HI (G), wordt het aangeduid als HI (AC). Het is om deze reden dat het in chemische vergelijkingen belangrijk is om de omgeving of fysieke fase te identificeren waarin reagentia en producten zijn geweest. Toch zijn verwarring tussen waterstofjodide en iartchloorzuur meestal gebruikelijk.
 Iarhydric Acid -ionen. Bron: Gabriel Bolívar.
Iarhydric Acid -ionen. Bron: Gabriel Bolívar. Als de toegewijde moleculen worden waargenomen in hun identiteit, zullen beruchte verschillen tussen HI (G) en HI (AC) worden gevonden. In de HI (G) is er een H-I-link; Terwijl ze in de HI (AC) zijn, zijn ze eigenlijk een paar ionen i- en h3OF+ Interactie elektrostátisch (superieure afbeelding).
Aan de andere kant is de HI (AC) een bron van HI (G), omdat de eerste wordt bereid door de ontbinding van de tweede in water. Daarom kan HI, tenzij het in een chemische vergelijking is, ook worden gebruikt om ook te verwijzen naar i -artrinezuur. De HI is een sterke reductiemiddel en een uitstekende bron van ionen i- In waterig medium.
[TOC]
Yodhydrinezuurstructuur
Yodhydrinezuur bestaat, zoals uitgelegd, uit een oplossing van HI in water. In het water zijn HI -moleculen volledig dissociëren (sterke elektrolyt), afkomstig uit de ionen i- en h3OF+. Deze dissociatie kan worden weergegeven met de volgende chemische vergelijking:
Hallo (G) + H2Of (l) => i-(AC) + H3OF+(AC)
Wat zou gelijkwaardig zijn als het wordt geschreven als:
Hallo (G) + H2Of (l) => hi (ac)
HI (AC) onthult echter helemaal niet wat er is gebeurd met de gasvormige HI -moleculen; Het geeft alleen aan dat ze zich in waterig medium bevinden.
Daarom bestaat de ware structuur van HI (AC) uit ionen i- en h3OF+ omgeven door watermoleculen die ze hydrateren; Hoe meer geconcentreerd het iarhydriczuur, hoe lager het aantal watermoleculen zonder proton.
Kan je van dienst zijn: Boyle LawCommercieel is de HI -concentratie in feite 48 tot 57% in water; Meer geconcentreerd zou gelijk zijn aan het hebben van een zuur te roken (en nog gevaarlijker).
In de afbeelding is te zien dat anion i- Het wordt weergegeven met een paarse bol, en h3OF+ Met witte bollen en een rood, voor zuurstofatoom. Het kation h3OF+ Presenteert moleculaire geometrie -trigonale piramide (gezien uit een hoger vlak in de afbeelding).
Eigenschappen
Fysieke beschrijving
Kleurloze vloeistof; Maar je kunt geelachtige en bruine tonen vertonen als je in direct contact bent met zuurstof. Dit komt omdat ionen i- Ze oxideren uiteindelijk moleculair jodium, ik2. Als er veel is2, Het is meer dan waarschijnlijk dat het triaduro -anion zal worden gevormd, i3-, die de oplossing als bruin bevlekt.
Moleculaire massa
127,91 g/mol.
Geur
Hectare.
Dikte
De dichtheid is 1,70 g/ml voor de 57%HI -oplossing; Sindsdien variëren de dichtheden afhankelijk van de verschillende concentraties van HI. Deze concentratie vormt een azeotrope (deze wordt gedestilleerd als een enkele stof en niet als een mengsel) waarvan de relatieve stabiliteit zijn commercialisering boven andere oplossingen kan zijn.
Kookpunt
De 57% HI Azeotrope kookt op 127 ° C bij een druk van 1,03 bar (pass naar ATM).
Pka
-1.78.
Zuurgraad
Het is een extreem sterk zuur, zo veel dat het corrosief is voor alle metalen en weefsels; Zelfs voor rubbers.
Dit komt omdat de H-I-link erg zwak is en gemakkelijk wordt verbroken tijdens zijn waterionisatie. Bovendien, waterstofbruggen i- - Huls2+ Ze zijn zwak, dus er is niets om de h te verstoren3OF+ reageren met andere verbindingen; dat wil zeggen h3OF+ heeft "gratis", zoals de i- dat trekt niet teveel aan voor zijn tegenion.
Kan u van dienst zijn: pycnometerReduceren
De HI is een krachtig reductiemiddel, wiens belangrijkste reactieproduct ik is2.
Nomenclatuur
De nomenclatuur van iarhydriczuur komt voort uit het feit dat de jodium "werkt" met een enkele oxidatietoestand: -1. En bovendien geeft de naam aan dat het water heeft in zijn structurele formule [i-] [H3OF+]. Dit is de enige naam, omdat het geen zuivere verbinding is, maar een oplossing.
Toepassingen
Jodiumbron in organische en anorganische synthese
De HI is een uitstekende bron van ionen i- voor anorganische en organische synthese, en is ook een krachtig reductiemiddel. De 57% waterige oplossing wordt bijvoorbeeld gebruikt voor de synthese van alkyljodiden (zoals Cho3Ch2I) van primaire alcoholen. Evenzo kan een OH -groep in een structuur vervangen door een i.
Reduceren
Yodhydrinezuur is gebruikt om bijvoorbeeld koolhydraten te verminderen. Als glucose in dit zuur wordt verwarmd, verliest het al zijn OH-groepen en verkrijgt het als een product de N-hexaankoolwaterstof.
Evenzo is het gebruikt om functionele groepen grafeenplaten te verminderen, zodat ze kunnen worden gefunctionaliseerd voor elektronische apparaten.
Cativa -proces
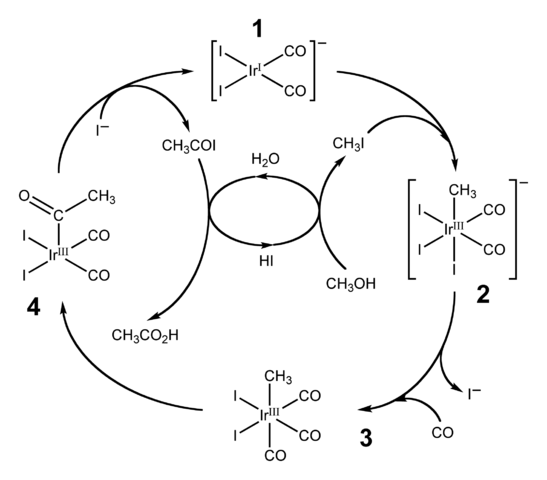 Diagram van de katalytische cyclus voor het Cativa -proces. Bron: Ben Mills [Public Domain Domain].De HI wordt ook gebruikt voor de industriële productie van azijnzuur door het Cativa -proces. Dit bestaat uit een katalytische cyclus waarin carbonilatie van methanol optreedt; dat wil zeggen, tot het molecuul van CH3Oh een carbonylgroep wordt geïntroduceerd, c = o, om te transformeren in chozuur3COOH.
Diagram van de katalytische cyclus voor het Cativa -proces. Bron: Ben Mills [Public Domain Domain].De HI wordt ook gebruikt voor de industriële productie van azijnzuur door het Cativa -proces. Dit bestaat uit een katalytische cyclus waarin carbonilatie van methanol optreedt; dat wil zeggen, tot het molecuul van CH3Oh een carbonylgroep wordt geïntroduceerd, c = o, om te transformeren in chozuur3COOH.
Stappen
Het proces begint (1) met het organo-iridiumcomplex [IR (CO)2Je2]-, van vierkante vlakke geometrie. Deze verbinding "ontvangt" het methyljodide, CH3Ik, product van cho -verzuring3Oh met 57% hallo. Water komt ook voor in deze reactie, en dankzij het wordt er aan het einde azijnzuur verkregen, terwijl de HI in de laatste stap kan herstellen.
Kan u van dienst zijn: colloïdeIn deze stap zowel de groep --ch3 Terwijl de -i zich bij het Ididio Metal Center (2) aansluit en een octaëdrisch complex vormt met een facet bestaande uit drie liganden en. Een van de Yodos vervangt zichzelf door een koolmonoxidemolecuul, CO; En nu (3) heeft het octaëdrische complex een facet bestaande uit drie co -liganden.
Dan treedt een herschikking op: de -ch -groep3 Het is "vrijgegeven" van IR en sluit zich aan bij de aangrenzende (4) om een acetylgroep te vormen, -coch3. Deze groep is vrijgegeven uit het Iridido -complex om te linken naar de jodide -ionen en cho te geven3COI, acetyljodide. Hier is de Iridium -katalysator hersteld, klaar om deel te nemen aan een andere katalytische cyclus.
Eindelijk, Cho3Coi lijdt een vervanging van de i- Voor een H -molecuul2Of wiens mechanisme eindigt door HI en azijnzuur vrij te geven.
Illegale synthese
 Efedrine -reductiereactie met rode fosforische en fosfore tot methaphetamine. Bron: Methampetamine_from_ephedrine_with_hi_ru.SVG: afgeleide Ring0 Trabajo: MaterialScientist (sprekend) [Public Domain].Yodhydrinezuur is gebruikt voor de synthese van psychotrope substantie die profiteert van de hoge reductieve kracht. U kunt bijvoorbeeld efedrine (een medicijn voor astma -behandeling) verminderen in aanwezigheid van rode fosfor, tot methamfetamine (superieur beeld).
Efedrine -reductiereactie met rode fosforische en fosfore tot methaphetamine. Bron: Methampetamine_from_ephedrine_with_hi_ru.SVG: afgeleide Ring0 Trabajo: MaterialScientist (sprekend) [Public Domain].Yodhydrinezuur is gebruikt voor de synthese van psychotrope substantie die profiteert van de hoge reductieve kracht. U kunt bijvoorbeeld efedrine (een medicijn voor astma -behandeling) verminderen in aanwezigheid van rode fosfor, tot methamfetamine (superieur beeld).
Het is te zien dat een vervanging van de OH -groep door de I, gevolgd door een tweede vervanging voor een h.
Referenties
- Wikipedia. (2019). Hydroiodinezuur. Opgehaald uit: in.Wikipedia.borg
- Andrews, Natalie. (24 april 2017). Het gebruik van hydriodinezuur. Wetenschap. Hersteld van: wetenschap.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodinezuur. Hersteld van: Alfa.com
- Nationaal centrum voor biotechnologie -informatie. (2019). Hydriodinezuur. PubChem -database., CID = 24841. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Steven A. Hardinger. (2017). Geïllustreerde woordenlijst van organische chemie: hydroiodinezuur. Hersteld van: chem.UCLA.Edu
- Reusch William. (5 mei 2013). Koolhydraten. Hersteld van: 2.Scheikunde.MSU.Edu
- In Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Reded trapheenoxide door chemische grafitisatie. Doi: 10.1038/ncomms1067.
- « Memoristische leerkenmerken, typen en voorbeelden
- Bioprocesses -kenmerken, typen, voordelen en fasen »

