Zwak zuur
- 4269
- 953
- Alton D'Amore
 Zwak zuur voorbeelden
Zwak zuur voorbeelden Wat is een zwak zuur?
Een zwak zuur is er een dat in waterige oplossing weinig capaciteit heeft om te dissociëren in waterstof (h+) en in de overeenkomstige geconjugeerde basis. In tegenstelling tot sterke zuren, waarvan de dissociatie compleet is (100%) en praktisch onomkeerbare, zijn zwakke zuren nauwelijks gedissocieerd en omkeerbaar.
Daarom genereert een zwak zuur minder hones h+ In water van wat zou worden verwacht. Onder de meest representatieve zwakke zuren hebben we azijnzuur, de belangrijkste component van azijn, die ongeveer in een 0 is.5 % onder normale omstandigheden.
Dit betekent dat het grootste aandeel van een azijnzuuroplossing in water, zoals 5%kookazijn, in niet -gedissocieerde vorm is (CH3COOH); Terwijl een klein deel wordt gevonden als de geconjugeerde basis (kies3Coo-), vergezeld van H -ionen+, of meer correct, H -ionen3OF+.
Als de hoeveelheid waterstof die wordt afgegeven door een zwak zuur in waterige oplossing is laag, is de pH die ze produceren hoger (basic) dan die geproduceerd door een sterk zuur. Azijn heeft bijvoorbeeld een pH van 2.5, sinaasappelsap pH 3.3. 4.2 en het 2 citroensap van 2.
Deze pH, hoewel ze zuur zijn, zijn hoger dan pH die een oplossing van een sterk zuur produceren (HCl, H2SW4, enz.) dat ze de waarde van 1 of minder kunnen bereiken (negatieve pH -waarden).
Kenmerken van zwakke zuren
pH van uw oplossingen
Zwakke zuren hebben meestal een pH tussen 2.0 en minder dan 7.0, dus ze draaien de kleur van het pannasolpapier in rood. Deze pH -waarden zijn veel hoger dan de pH -waarden geproduceerd door sterke zuren, hoewel er uitzonderingen zijn.
Een 1 mM zoutzuuroplossing (een sterk zuur) heeft bijvoorbeeld een pH van 3.0, terwijl een 1 mm oplossing van fluorhorinezuur (een "zwak" zuur) een pH van 3 heeft.2, die dicht bij die van sterk zuur ligt.
Gedeeltelijke ionisatie
Zwakke zuren in oplossing worden weinig of gedeeltelijk in water geïoniseerd, dissociërend in de geconjugeerde basis van zuur en waterstofion. Vervolgens wordt een zwak zuur in waterige oplossing meestal gedissocieerd, met een klein gedissocieerd deel.
Kan u van dienst zijn: evenwicht tussen chemische vergelijkingenWanneer de hoeveelheid waterstof die wordt afgegeven door een zwak zuur in water laag is, is de pH geproduceerd door dit zuur hoger dan die geproduceerd door een sterk zuur opgelost in water, omdat deze meestal met 100 % worden geïoniseerd.
Omkeerbare ionisatie
De ionisatie van een zwak zuur wordt meestal als volgt gepresteerd:
Heeft ⇌ a- + H3OF-
Waar is er zwak zuur, aan- zijn geconjugeerde basis, en h3OF+ het hydroniumkation, dat is de manier in h+ Het bestaat of gemanifesteerd in het water. De concentratie (of activiteit) van h3OF+ Het wordt gebruikt in plaats van h+ Voor de bepaling van de oplossing van de oplossing.
Ionisatie graad
Sommige zuren zijn zwakker dan andere, wat hetzelfde is om te zeggen, ze zijn minder geïoniseerd. Daarom stelt de mate van ionisatie ons in staat om een glimp op te vangen hoe zuur een zuur onder bepaalde omstandigheden is.
Om de mate van ionisatie uit te drukken, werden verschillende parameters geïntroduceerd, zoals de ionisatie- of zuurgraadconstante (KA) en de PKA: een manier om KA uit te drukken in een eenvoudig getal dat het gebruik weglaat van een getal dat wordt uitgedrukt in negatieve bevoegdheden van tien (10 ), zoals het bestaat in de KA.
KA- en PKA -constanten worden voornamelijk gebruikt voor zwakke zuren.
Ka = [a-] [H+] / [Ha]
De haakjes aanwezig in de formule vertegenwoordigen concentraties.
pka = - log ka
De PKA -waarde van een zwak zuur varieert meestal tussen 2 en 12. Maar er zijn uitzonderingen. Bijvoorbeeld: en en odagisch zuur (HIO3) heeft een PKA van 0.77, die als een relatief kleine waarde wordt beschouwd, maar zonder negatief te zijn, voor een zwak zuur in strikte zin.
Geconjugeerde basisstabiliteit
Zwakke zuren hebben een sterke binding met zuurwaterstofatoom (Hδ+-Xδ-), dus ze hebben een lage mate van dissociatie van waterstof. Dit resulteert in de geconjugeerde basis van zwak zuur heeft een grote aviditeit door waterstof, is een sterke geconjugeerde basis.
Kan u van dienst zijn: colloïdeDat wil zeggen, de geconjugeerde basis van een zwak zuur is zeer onstabiel, omdat het h accepteert+ keerde heel gemakkelijk terug. Hoe onstabieler deze geconjugeerde basis, hoe zwakker het zuur in twijfel wordt getrokken.
Lage ionische geleidbaarheid
Als weinig geïoniseerde, zijn zwakke zuren slechte elektriciteitsgeleiders, in tegenstelling tot sterke zuren die goede elektriciteitsgeleiders zijn.
Aanwezigheid in de natuur
Zwakke zuren zijn wijd verspreid van aard, ze zijn bijvoorbeeld in citrusvruchten (citroen, grapefruit, sinaasappel, enz.).
Ze zijn ook aanwezig in tal van processen die zich voordoen in alle levende wezens. Sommige van deze biologische zwakke zuren zijn pyruvisch, lactisch, citroenachtig, fumarisch, succinisch, glutamisch, enz., En zelfs geoxygeneerde hemoglobine geeft waterstofs, dus het gedraagt zich als een zwak zuur.
Vervolgens kan worden geconcludeerd dat de mens in permanent contact leeft met zwakke zuren.
Hoe de pH van een zwak zuur te berekenen?
De pH van een zwak zuur kan worden berekend met behulp van de zure constante (ka) of met behulp van de Henderson-Haselbalch-vergelijking. In het eerste voorbeeld zal KA worden gebruikt.
Met zuurgraad constant
Bereken de pH van een oplossing 0.5 m benzoëzuur (c6H5COOH), die een ionisatieconstante heeft (ka) = 1.8 x 10-5
C6H5COOH ⇌ C6H5Coo- + H+ (1)
Als de hoeveelheid zuur die dissocieert, X wordt genoemd, dan 0.5 m-X zal de concentratie van zwak zuur zijn die niet in evenwicht is gedissocieerd, met x de concentratie van de conjugaatbasis van benzoëzuur- en waterstofionconcentratie.
Vergelijking (1) kan als volgt worden weergegeven:
0.5 m-x ⇌ x +x
Zwakke zuren worden geïoniseerd in een zeer lage verhouding, dus de concentratie benzoëzuur in de balans van (0.5 m-x), kan worden aangenomen als 0.5 m, sinds x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Daarom [h+] is gelijk aan 3 x 10-3 M. We lossen vervolgens op door de pH te berekenen:
Het kan u van dienst zijn: Mohr -methode: fundamentals, reacties, procedure, gebruikpH = - log [h+]
= - log [3 x 10-3]
pH = 2.52
Merk op dat de pH relatief zuur is, omdat deze zich onder 3 of 4 bevindt.
Met Henderson-Haselbalch-vergelijking
Henderson-Haselbalch-vergelijking wordt gebruikt om de pH van een bufferoplossing te berekenen:
pH = PKA + log [geconjugeerde basis] / [zuur]
Voorbeeld:
Natriumhydroxide (NaOH) wordt toegevoegd aan een oplossing voor azijnzuur, waardoor een eindconcentratie van azijnzuur wordt geproduceerd (CH3COOH) 1.11 x 10-2 mol/l en een geconjugeerde basisconcentratie (kies3Coo-) van 0.44 x 10-2 mol/l. Als azijnzuur pka 4 is.75 Bereken de pH van de oplossing.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +log (0.44 x 10-2 / 1.11 x 10-2))
= 4.75+ Log 0.396
= 4.348
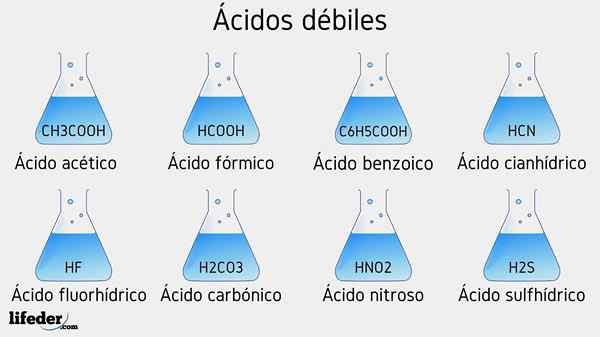
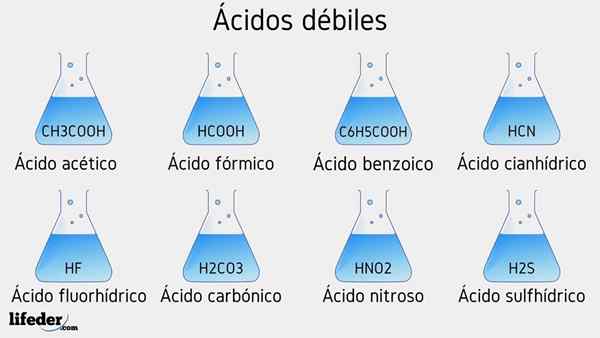
Zwak zuur voorbeelden
Verschillende zwakke zuren vergezeld van hun PKA -waarden worden hieronder vermeld:
- Ch3COOH (azijnzuur), PKA 4.75
- HCOOH (mierenzuur), PKA 3.74
- C6H5COOH (benzoëzuur), PKA 5.59
- Ch2Clcooh (chloorazijnzuur), PKA 2.85
- HCN (cyanhydriczuur), PKA 9.31
- HF.17
- C2H5COOH (propionzuur), PKA 4.89
- Hno2 (Stikstofzuur), PKA 3.35
- H2S (sulfidezuur), PKA1 6.0 en PKA2 12.92
- CCL3COOH (trichloorazijnzuur), PKA 0.52
- H2CO3 (carbonzuur), PKA1 6.37 en PKA2 10.22
- H3Po4 (fosforzuur), PKA1 2.12, PKA2 4.21 en PKA3 elf.0
- C6H5SW3H (benzefonzuur), PKA 0.70
- Hio3 (Yodiumzuur), PKA 0.77
- HCLO2 (Chloorzuur), PKA 2.0
- Ch3Ch2(OH) COOH (melkzuur), PKA 3.08
Zwakke zuren met therapeutisch gebruik
- Salicylzuur, PKA 3.00
- Acetylsalicylzuur, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, pka 4.40
- Levodopa, pka 2.30
- Fenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Morris, J. G. (1974). Fysicochemie voor biologen. (2e ed.)). Ik heb omgekeerd.
- Helmestine, Anne Marie, pH.D. (29 augustus 2020). Zwak zuurdefinitie en voorbeeld in de chemie. Hersteld van: Thoughtco.com
- Ophardt C., & McCarthy L. (15 augustus 2020). Zure en basissterkte. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Clark Jim. (2013). Sterk en zwak zuur. Hersteld van: chemguide.co.Uk
- Lumen leren. (S.F.)). Chemie voor niet-majors: het berekenen van de pH van zwakke zuur- en basisoplossingen. Hersteld van: cursussen.Lumenarning.com

