Kaliumbromide (KBR) structuur, eigenschappen, gebruik
- 5085
- 721
- Nathan Wiegand
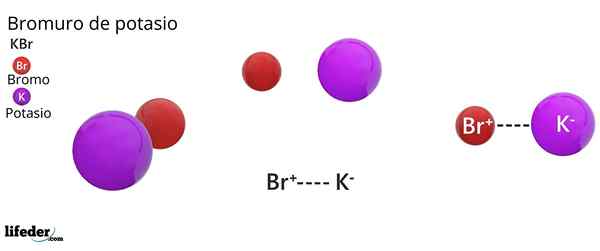
Hij kaliumbromide Het is een anorganisch zout waarvan de chemische formule KBR is. Het wordt gevormd door de elektrostatische unie van een bromide -anion, Br-, En een kaliumkation, k+, in een 1: 1 aandeel; dat wil zeggen, we hebben dezelfde hoeveelheid BR- vanaf k+ In KBR -kristallen.
Kaliumbromide is een vast wit of kristallijn zout, het is reukloos, zeer oplosbaar in water en weinig oplosbaar in ethanol en ethanol. Het werd gebruikt tijdens het laatste deel van de 19e eeuw en een groot deel van de twintigste eeuw in de behandeling van epilepsie en als kalmerend middel.
Tot 1975 bleef het vrijuit verkopen, het jaar waarin het gebruik ervan afnam vanwege de toxische effecten die het op patiënten produceerde. Momenteel wordt het nog steeds gebruikt bij verschillende soorten dieren bij de behandeling van aanvallen, hoewel het vanaf 1912 werd vervangen door natriumfenobarbital.
Kaliumbromide wordt gebruikt in optische studies die overeenkomen met het nabijgelegen infraroodgebied van het elektromagnetische spectrum. Het dient ook als materiaal dat wordt gebruikt op het gebied van fotografie.
[TOC]
Linktype
Kaliumbromide is een binair zout, product van de combinatie van een broomatoom met een oxidatietoestand -1, met een kaliumatoom met een oxidatietoestand +1. Daarom wordt een elektrische aantrekkingskracht tussen de ionen BR gevestigd- En het K -ion+.
Dit type elektrische of elektrostatische interactie staat bekend als een ionische binding, die dissocieert wanneer kaliumbromidezout in het water oplost en de kionen vrijgeeft+ en br-.
Deze ionen worden uiteengevallen door waterbezitters.
Kaliumbromidestructuur
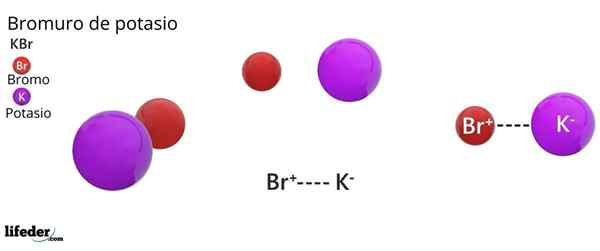
 Kristalstructuur FCC van de KBR: de bruine bollen komen overeen met de br-, terwijl de violette bollen overeenkomen met de kationen k+
Kristalstructuur FCC van de KBR: de bruine bollen komen overeen met de br-, terwijl de violette bollen overeenkomen met de kationen k+ Kaliumbromide presenteert een kubieke kristallijne structuur gecentreerd op het gezicht (FCC) Gezichtsgerichte kubus), gelijk aan die waargenomen in natriumchloride.
Kan u van dienst zijn: Faraday ConstantIn deze structuur, elk anion BR- Het is gekoppeld of gecoördineerd met zes k -kationen+, En op zijn beurt, elke k+ Het heeft zes BR- Als buren in kristallijne netwerken.
Nomenclatuur
Kaliumbromide wordt geclassificeerd als een halogenide- of alkalisch metaalhalogenide. De namen van deze zouten worden geconstrueerd door de laatste letter van de naam van de halogeen te elimineren (chloor, broom, jodium, fluor en astato), met uitzondering van fluoride, en de laatste brief te vervangen door het achtervoegsel -uro. De naam van het metaal is hieronder geschreven zonder aanpassing.
Bijvoorbeeld: natriumchloride, kaliumjodide, calciumfluoride, enz. Daarom wordt de KBR kaliumbromide of kaliumbromide genoemd (volgens de traditionele nomenclatuur).
Kaliumbromide -eigenschappen
 Klokschijf met KBR -korrels. Bron: Walkerma via Wikipedia.
Klokschijf met KBR -korrels. Bron: Walkerma via Wikipedia. Fysiek uiterlijk
Kleurloos glas, kristallijne of witte korrels.
Geur
Toilet
Smaak
Bij een hoge concentratie heeft het een bittere en kruidige smaak.
Molaire massa
119.02 g/mol
Dikte
2.74 g/cm3 bij 25 ºC
Smeltpunt
734 ºC
Kookpunt
1435 ºC
Oplosbaarheid in water
535 g/l A 0 ºC
678 g/l A 25 ºC
1020 g/l A 100 ºC
1 gram zout wordt opgelost in 1 ml kokend water, wat aangeeft dat het zeer oplosbaar is in water.
Oplosbaarheid in glycerol
217 g/l
1 gram kaliumbromide lost op in 4.6 ml glycerol.
Ethanol -oplosbaarheid
47.6 g/l A 80 ºC.
1 gram kaliumbromide lost op in 250 ml ethanol.
Dampdichtheid
7.14 in de luchtrelatie die als de eenheid is genomen.
Stabiliteit
Stabiel indien opgeslagen onder de aanbevolen omstandigheden. Onverenigbaar met oxidatiemiddelen, sterke zuren, broomtrifluoride en broom.
Ontleding
Wanneer verwarmd tot ontleding stoten schadelijke producten uit, zoals waterstofbromide en kaliumoxide.
Kan u van dienst zijn: Kernel Elektronische configuratie: constructie, voorbeeldenBrekingsindex (ND)
1.559
pH
In waterige oplossing produceert een neutrale pH, ongeveer 7.
ontstekingspunt
1435 ºC
Oplossing en reactiviteit
In waterige oplossing is de KBR volledig gedissocieerd om een neutrale pH -oplossing te veroorzaken.
Zout is een bron van bromide die kan worden gebruikt voor de productie van zilveren bromide, AGBR, verbinding die wordt gebruikt bij de ontwikkeling van foto's:
KBR (AC) +Agno3 (AC) → AGBR (S) +KNO3 (AC)
Ook is de KBR een zwak reductiemiddel, onverenigbaar met kwik en zilveren zouten. Produceert een gewelddadige reactie met bromine trifluoride. Kan reageren met veel zouten, alkaloïden en zetmeel.
Het reageert ook met zuren, bijvoorbeeld met geconcentreerd zwavelzuur, wat waterstofbromide vrijgeeft.
Toepassingen
Epilepsie- en aanvallen behandeling
De anticonvulsieve eigenschappen van kaliumbromide werden voor het eerst blootgesteld door Sir Charles Locock, tijdens een bijeenkomst van de Royal Medicine and Chirurgical Society in 1857, die het gebruik ervan bij de behandeling van epilepsie bevorderde.
Kaliumbromide werd gebruikt als prioritaire medicatie bij de behandeling van epilepsie en als kalmerend middel tot 1912, toen het natriumfenobarbital werd aangekondigd.
Toch werd het nog steeds gebruikt als een aanvulling op het natriumfenobarbital bij de behandeling van epilepsie aanvallen.
In het jaar 1975, vanwege het giftige karakter, de FDA U.S. (Food & Drug Administration) besloot het gebruik van kaliumbromide niet aan te bevelen, zowel bij mensen als bij dieren. Sommige landen bleven het echter beheren.
Kaliumbromide werd gebruikt als hypnotisch en kalmerend bij vee, paarden, schapen en varkens. Het werd ook gebruikt bij de behandeling van koliek en tetania bij paarden en bij de behandeling van aanvallen bij honden.
Infrarood optica
Vanwege de transparantie van de kaliumbromide in een bereik van golflengten tussen het ultraviolet licht en het bijna infrarood, wordt het gebruikt als een component van de ramen voor verschillende elektromagnetische straling, met name infraroodstraling.
Kan u van dienst zijn: osmolariteitIn dit opzicht worden verschillende technieken gebruikt. Een van hen bestaat uit de uitwerking van twee kristallijne schijven van kaliumbromide en plaatst een film van het materiaal dat in het infrarood in de albums wordt geanalyseerd. De studies worden uitgevoerd in het nabije infrarood tussen 780 nm en 3000 nm.
Fotografie
 De KBR maakte deel uit van de materialen die werden gebruikt om de eerste foto's van de twintigste eeuw te verwerken
De KBR maakte deel uit van de materialen die werden gebruikt om de eerste foto's van de twintigste eeuw te verwerken Kaliumbromide heeft bijvoorbeeld talloze toepassingen en toepassingen in fotografie gehad: het is gebruikt om fotografieontwikkelaars te formuleren, in de productie van fotografische films, als een film dikkerig en als een kleurbleekmiddel in kleur.
Het wordt gebruikt bij de verbetering van de differentiatie tussen de zilverhalogenidenkristallen blootgesteld en niet blootgesteld, in de toename van de drukdichtheid van dunne negatieven, en als secundair halogenide, in combinatie met jodiden, voor de verwerking van negatief papier op papier op papier op papier op papier.
Het is ook gebruikt in combinatie met kwikbichloride, kopersulfaat of kalium ferricicieurio in fotografische tribunes. Het heeft ook gediend als een beperker bij alkalische ontwikkelaars die worden gebruikt voor gelatineplaten en ontwikkelingspapieren.
Chemische analyse
De KBR wordt gebruikt bij het bepalen van de beoordeling van koper en zilver, in de polarografische analyse van de Indiaan, cadmium en arseen.
Andere gebruiken
Het wordt gebruikt in lithografie -gravureprocessen, in de olieverwerking, bij de thermische stabilisatie van het nylon, bij de vervaardiging van vezels en uiteindelijk bij de productie van speciale zeep.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Dag, r., & Underwood, een. (1986). Kwantitatieve analytische chemie (Vijfde ed.)). Pearson Prentice Hall.
- Wikipedia. (2020). Kaliumbromide. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2021). Kaliumbromide. PubChem Comunund Samenvatting voor CID 253877. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- EMEA. (1999). Bromide, kaliumzout: samenvatting rapport. [PDF]. Hersteld van: EMA.Europa.EU
- Sevier B.V. (2020). Kaliumbromide. Wetenschappelijk. Opgehaald uit: Scientedirect.com

