Galvanic Cell -onderdelen, hoe werkt, toepassingen, voorbeelden

- 3247
- 674
- Alton D'Amore
De Galvanische cel o Voltaïsche cel is een type elektrochemische cel die bestaat uit twee verschillende metalen die zijn ondergedompeld in twee semi -nllads, waarbij een verbinding in actieve oplossing een spontane reactie is.
Vervolgens wordt een van de metalen in een van de semi -nllads geoxideerd terwijl het metaal van de andere semi -media wordt verminderd, waardoor een uitwisseling van elektronen door een extern circuit wordt geproduceerd. Hierdoor kunt u profiteren van de elektrische stroom.
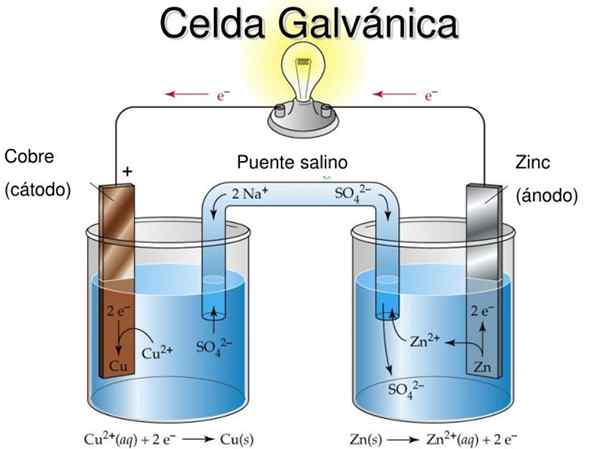
 Figuur 1. Schema en delen van een galvanische cel. Bron: Korinthe.PUCP.Edu.pe.
Figuur 1. Schema en delen van een galvanische cel. Bron: Korinthe.PUCP.Edu.pe. De naam "Galvanic Cell" is ter ere van een van de pioniers van experimenten met elektriciteit: de Italiaanse arts en fysioloog Luigi Galvani (1737-1798).
Galvani ontdekte in 1780 dat als ze zich bij één uiteinde kabels van verschillende metalen hebben aangesloten en de vrije uiteinden in contact werden gebracht met de ANCA van een kikker (dood), er een samentrekking plaatsvond.
De eerste die een elektrochemie-cel bouwde om elektriciteit te produceren, was echter ook de Italiaanse Alessandro Volta (1745-1827) in 1800 en dus de alternatieve naam van de voltaische cel.
Delen van de galvanische cel
De delen van een galvanische cel worden getoond in figuur 1 en zijn de volgende:
1.- Anodische semi -media
2.- Anodiumelektrode
3.- Anodische oplossing
4.- Kathodische semi -media
5.- Kathodische elektrode
6.- Kathodische oplossing
7.- Zoutoplossing
8.- Metaalgeleider
9.- Voltmeter
Werking
Om het functioneren van een galvanische cel uit te leggen, zullen we op de lagere vertrouwen:
 Figuur 2. Galvanic Cell Didactic Model. Bron: glijden.com
Figuur 2. Galvanic Cell Didactic Model. Bron: glijden.com Het fundamentele idee van een galvanische cel is dat het metaal dat door de oxidatiereactie leed, fysiek wordt gescheiden van het metaal dat wordt verminderd, zodat de uitwisseling van elektronen optreedt via een externe geleider die het mogelijk maakt om te profiteren van de stroom van elektrische stroom , Bijvoorbeeld om een lamp of led aan te steken.
In figuur 2 in de semi -media aan de linkerkant heb je een metalen koperen tape (Cu) ondergedompeld in een kopersulfaatoplossing (CUS04), Terwijl in de juiste semi -lid een zinktape (Zn) is ondergedompeld in een zinksulfaatoplossing (ZnSo4)).
Opgemerkt moet worden dat in elke semi -media het metaal van elk aanwezig is in twee oxidatietoestanden: de neutrale metaalatomen en de metaalionen van het zout van hetzelfde metaal in oplossing.
Als de metalen banden niet worden gekoppeld door een buitengeleidende kabel, dan oxideren beide metalen afzonderlijk in hun respectieve cellen.
Wanneer het echter elektrisch is aangesloten, zal oxidatie optreden in de Zn terwijl er een reductiereactie in Cu zal zijn. Dit komt omdat de mate van oxidatie van zink groter is dan die van koper.
Het metaal dat oxideert de opbrengsten naar het metaal dat wordt gereduceerd door de buitenste geleider en deze stroom kan worden gebruikt.
Kan u van dienst zijn: gehalogeneerde derivatenOxidatie- en reductiereacties
De reactie die zich aan de rechterkant tussen de zinkmetaalelektrode en de waterige zinksulfaatoplossing voordoet, is als volgt:
Znof(S) + Zn2+ (SW4))2- → 2 Zn2+(AC) + (SW4))2- + 2 e-
Een atoom van zink (vast) op het oppervlak van de anodische elektrode in de semi -the -recht van rechts, gestimuleerd door de positieve ionen van het zink in oplossing, levert twee elektronen op en komt uit de elektrode, naar de waterige oplossing Als een positief dubbele ion van zink.
We realiseerden ons dat het netto resultaat was dat een atoom van neutraal metaalzink, door twee elektronen te verliezen, een ion van zink werd dat bijdraagt aan de waterige oplossing, zodat de zinkbalk een atoom verloor en de oplossing een positief dubbel ion kreeg.
Liberated Electron zal liever door de externe kabel gaan naar het metaal van de andere semi -media met positieve belasting (Cartodo +). De zinkbalk verliest massa omdat de atomen geleidelijk overgaan naar de waterige oplossing.
Zinkoxidatie kan als volgt worden samengevat:
Znof(S) → Zn2+(AC) + 2 e-
De reactie die aan de linkerkant optreedt, is vergelijkbaar, maar het koper van de waterige oplossing legt twee elektronen vast (afkomstig van de andere semi -thema) en wordt afgezet in de koperen elektrode. Wanneer een atoom elektronen vangt, wordt gezegd dat het wordt verminderd.
De koperen reductiereactie is als volgt geschreven:
Cu2+(AC) + 2 e- → Cuof(S)
De koperen balk wint deeg, omdat de ionen van de oplossing naar de balk passeren.
Oxidatie treedt op in de anode (negatief), die elektronen afstoot, terwijl de reductie optreedt in kathode (positief), die elektronen aantrekt. Elektronenuitwisseling vindt plaats via de externe stuurprogramma.
De zoutoplossingbrug
De zoutoplossing -brug balanceert de belastingen die zich ophopen in de twee semi -lies. In de anodische semi -diade positieve ionen accumuleren, terwijl in het kathodische een overmaat aan negatieve sulfaationen is.
Voor de zoutoplossing wordt een oplossing van een zout (zoals natriumchloride of kaliumchloride) gebruikt die niet tussenbeide komt in de reactie, die zich in een omgekeerde U -vormige buis bevindt met zijn uiteinden aangesloten met een wand van poreus materiaal.
Het enige doel van de zoutoplossing is dat de ionen worden gefilterd naar elke celbalancering of neutraliserende overtollige belasting. Dus door de zoutoplossing is er een stroomstroom, door de zoutoplossing, die het elektrische circuit sluit.
Oxidatie- en reductiepotentialen
Standaard oxidatie- en reductiepotentialen worden begrepen.
Het kan u van dienst zijn: Scandio: Geschiedenis, eigenschappen, reacties, risico's en gebruikVoor zink is het standaard oxidatiepotentieelos = +0,76 V. Ondertussen is het standaardreductiepotentieel voor koper enrooster = +0.34 V. De elektromotorische kracht (FEM) geproduceerd door deze galvanische cel is: FEM = +0,76 V + 0,34 V = 1,1 V.
De globale reactie van de galvanische cel kan zo worden geschreven:
Znof(S) + Cu2+(AC) → Zn2+(AC) + Cuof(S)
Rekening houdend met sulfaat is de netto reactie:
Znof(S) + Cu2+ (SW4))2- 25ºC → Zn2+ (SW4))2-+ Cuof(S)
Sulfaat is een toeschouwer, terwijl metalen elektronen uitwisselen.
Symbolische weergave van een galvanische cel
De galvanische cel van figuur 2 is symbolisch als volgt weergegeven:
Znof(S)| Zn2+(AC) (1M) || Cu2+(AC) (1m) | Cuof(S)
Volgens de conventie wordt het metaal dat de anode (-) (-) en gescheiden door een balk (|), zijn ion in waterige toestand altijd wordt geplaatst en wordt gescheiden en gescheiden door een balk (|). Het anodische semi -medium wordt gescheiden van het kathodische door twee staven (||) die de zoutoplossing weergeeft. Aan de rechterkant wordt het metalen semi -medium dat wordt verminderd en de kathode (+) geplaatst.
In de symbolische weergave van een galvanische cel is het uiteinde altijd het metaal dat oxideert en aan het einde wordt het metaal geplaatst (in vaste toestand) dat wordt verminderd. Opgemerkt moet worden dat in figuur 2 de semi's omgekeerd zijn met betrekking tot conventionele symbolische weergave.
Toepassingen
Bekend de standaard oxidatiepotentialen van verschillende metalen is het mogelijk om de elektromotorische kracht te bepalen die een galvanische stapel zal produceren gebouwd met deze metalen.
In deze sectie is het bovenstaande in de vorige paragrafen van toepassing om de netto elektromotorische kracht van een cel te berekenen die is gebouwd met andere metalen.
Als een voorbeeld van toepassing beschouwen we een galvanische ijzeren cel (geloof) en koper (Cu). Als gegevens worden de volgende reductiereacties en het standaardreductiepotentieel ervan gegeven, dat wil zeggen bij een concentratie van 25 ° C en 1M:
Vertrouwen2+(AC) + 2 e- → geloof(S). E1rooster = -0.44 V
Cu2+(AC) + 2 e- → Cu(S). E2rooster = +0.34 V
Er wordt gevraagd om de netto elektromotorische kracht te vinden die door de volgende galvanische cel wordt geproduceerd:
Vertrouwen(S)| Geloof2+(AC)(1m) || Cu2+(AC)| Cu(S)
In deze stapel oxideert het ijzer en is de anode van de galvanische cel, terwijl het koper wordt verminderd en de kathode is. Het ijzeroxidatiepotentieel is hetzelfde, maar in tegenstelling tot het reductiepotentieel ervan, dat wil zeggen E1Ossen = +0.44.
Om de elektromotorische kracht te verkrijgen die door deze galvanische cel wordt geproduceerd, voegen we het ijzeroxidatiepotentieel toe aan de koperen reductiepotentieel:
Kan u van dienst zijn: stikstofoxiden (NOx)FEM = E1Ossen + E2rooster = -E1rooster + E2rooster = 0,44 V + 0,34 V = 0,78 V.
Galvanische cel in het dagelijks leven
Galvanische cellen voor dagelijks gebruik zijn verre van de vorm die wordt gebruikt als een didactisch model, maar hun werkingsprincipe is hetzelfde.
De meest voorkomende gebruikscel is 1,5 V alkalische batterij in zijn verschillende presentaties. De voornaam komt omdat het een set cellen is die in serie is verbonden om de FEM te vergroten.
Oplaadbare lithiumbatterijen zijn ook gebaseerd op hetzelfde werkingsprincipe van galvanische cellen en zijn die gebruikt in smartphones, horloges en andere apparaten.
Op dezelfde manier zijn de loodbatterijen van auto's, motorfietsen en boten 12V en zijn gebaseerd op hetzelfde werkingsprincipe van de galvanische cel.
Galvanische cellen worden gebruikt in esthetiek en spierregeneratie. Er zijn gezichtsbehandelingen die bestaan uit het aanbrengen van stroom door twee elektroden in de vorm van een rol of bol die de huid reinigen en tonifiëren.
Huidige pulsen zijn ook van toepassing om het spierstelsel te regenereren bij mensen die in een staat van uitputting zijn.
Constructie van een zelfgemaakte galvanische cel
Er zijn veel manieren om een zelfgemaakte galvanische cel te bouwen. Een van de eenvoudigste is het gebruik van azijn als oplossing, stalen nagels en koperen kabels.
Materialen
-Wegwerp plastic vaten
-witte azijn
-Twee stalen schroeven
-Twee stukken naakte koperdraad (zonder isolerend of vernis)
-Een voltmeter
Procedure
-Vul ¾ delen van het glas met azijn.
-Sluit de twee stalen schroeven aan met verschillende draaiingen, waardoor een stuk draad achterblijft zonder te wikkelen.
Het eindeloze uiteinde van de koperen kabel is gevouwen in een omgekeerde U -vorm.
 figuur 3. Zelfgemaakte galvanische cel en multimeter. Bron: YouTube.com
figuur 3. Zelfgemaakte galvanische cel en multimeter. Bron: YouTube.com Een ander stuk koperen kabel wordt ook in een omgekeerde gevouwen en hangt aan de rand van het glas in diametraal tegenovergestelde positie ten opzichte van de ondergedompelde schroeven, zodat het ene deel van het koper zich in de azijn bevindt en het andere deel van de koperen kabel aan de buitenkant van het glas.
De vrije uiteinden van de voltmeter -kabels zijn verbonden om de elektromotorische kracht te meten die door deze eenvoudige cel wordt geproduceerd. De FEM van dit type cel is 0,5 V. Om de FEM van een alkalische batterij te matchen, is het noodzakelijk om nog twee cellen te bouwen en de drie in serie aan te sluiten, zodat een 1,5V -batterij wordt verkregen
Referenties
- Borneo, r. Galvanische en elektrolytische cellen. Opgehaald uit: Quimica -klassen.Blogspot.com
- Cedrón, J. Algemene scheikunde. PUCP. Hersteld van: Korinthe.PUCP.Edu.pe
- Farrera, L. Inleiding tot elektrochemie. Unam Physicochemistry Department. Hersteld van: depa.Fquim.UNAM.mx.
- Wikipedia. Elektrochemische cel. Hersteld van: is.Wikipedia.com.
- Wikipedia. Galvanische cel. Hersteld van: is.Wikipedia.com.

