Veranderingen van staatstypen en hun kenmerken (met voorbeelden)
- 994
- 20
- Dewey Powlowski
De Staat aan veranderingen of fase zijn een thermodynamisch fenomeen waarbij materie omkeerbare fysieke veranderingen ervaart. Er wordt gezegd dat het thermodynamisch is omdat een warmteoverdracht optreedt tussen materie en omgeving; Of wat hetzelfde is, er zijn interacties tussen materie en energie die een herschikking van deeltjes veroorzaken.
De deeltjes die de statusverandering ervaren, blijven voor en na hetzelfde hetzelfde. De druk en temperatuur zijn belangrijke variabelen in hoe deze in een of andere fase worden ondergebracht. Wanneer een toestandsverandering optreedt, wordt een bifasisch systeem gevormd, bestaande uit dezelfde materie in twee verschillende fysieke toestanden.
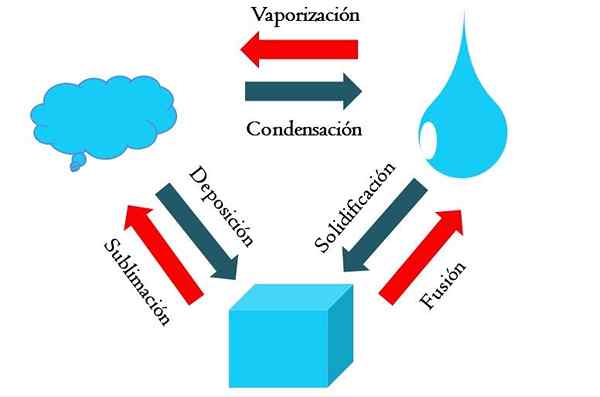
 Staat aan veranderingen. Bron: Gabriel Bolívar
Staat aan veranderingen. Bron: Gabriel Bolívar Het hogere beeld toont de belangrijkste staatsveranderingen die er onder normale omstandigheden van worden ervaren.
Een vaste kubus van een blauwachtige stof kan vloeibaar of gasvormig worden, afhankelijk van de temperatuur en druk van de omgeving. Op zichzelf vertegenwoordigt het een enkele fase: de vaste stof. Maar op het moment van smelten, dat wil zeggen, smelt, een vaste-vloeistofbalans genaamd fusie (rode pijl tussen de emmer en de blauwe druppel is vastgesteld).
Om de fusie op te treden, moet de kubus warmte van zijn omgeving absorberen om de temperatuur te verhogen; Daarom is het een endotherme proces. Zodra de kubus gesmolten is, is deze opnieuw een enkele fase: die van de vloeibare toestand.
Deze blota kan warmte blijven absorberen, wat de temperatuur verhoogt en aanleiding geeft tot de vorming van gasvormige bubbels. Nogmaals, er zijn twee fasen: de ene vloeistof en de andere frisdrank. Wanneer alle vloeistof door zijn kookpunt is verdampt, wordt dan gezegd dat deze is gekookt of verdampt.
Nu werden blauwachtige druppels omgezet in wolken. Tot nu toe zijn alle processen endothermisch geweest. Blauwachtig gas kan warmte blijven absorberen totdat het is verwarmd; Gezien de terrestrische omstandigheden heeft dit echter de neiging om opnieuw te koelen en opnieuw te condenseren in de vloeistof (condensatie).
Aan de andere kant kunnen wolken ook direct in een vaste fase worden afgezet, waardoor de vaste kubus opnieuw wordt gevormd (afzetting). Deze laatste twee processen zijn exotherme (blauwe pijlen); dat wil zeggen, ze geven warmte vrij aan de omgeving of rond.
Naast condensatie en afzetting is er een verandering van toestand wanneer de blota bevriest bij lage temperaturen (stolling).
[TOC]
Soorten staatsveranderingen en hun kenmerken
De afbeelding toont de typische veranderingen voor de drie (meest voorkomende) toestanden van materie: vast, vloeistof en gasvormig. De veranderingen die door de rode pijlen worden vergezeld, zijn endotherm, ze impliceren warmteabsorptie; Terwijl die vergezeld van blauwe pijlen exotherme zijn.
Een korte beschrijving van elk van deze wijzigingen zal hieronder worden aangebracht, waarbij enkele van de kenmerken van een moleculaire en thermodynamische redenering worden benadrukt.
- Fusie
Fusie is de verandering van toestand van een stof van de vaste toestand naar de vloeistof.

In vaste toestand de deeltjes (ionen, moleculen, clusters, enz.) zijn "gevangenen", gelegen in vaste ruimtes zonder vrij te kunnen bewegen. Ze zijn echter in staat om te trillen op verschillende frequenties, en als deze erg sterk zijn, zal de rigoureuze volgorde opgelegd door intermoleculaire krachten "afbrokkelen.
Als gevolg hiervan worden twee fasen verkregen: een waar de deeltjes doorgaan (vast) en een andere waar ze vrijer zijn (vloeistof), genoeg om de afstanden te vergroten die ze van elkaar scheiden. Om dit te bereiken, moet de vaste stof warmte absorberen, en dus zullen zijn deeltjes trillen met een grotere kracht.
Het kan u van dienst zijn: Atomic Mass: Definitie, Typen, hoe het te berekenen, voorbeeldenOm deze reden is de fusie endotherm, en wanneer deze begint wordt gezegd dat er een evenwicht tussen de vaste vloeistoffasen optreedt.
De hitte die nodig is om aanleiding te geven tot deze verandering, wordt warmte of smeltentalpie genoemd (ΔHFus)). Dit drukt de hoeveelheid warmte uit (voornamelijk energie, in KJ -eenheden) die een mol van vaste toestand moet absorberen om te smelten, en niet alleen zijn temperatuur verhogen.
Sneeuwbal
 Smeltende sneeuw met de hand. Bron: Pixabay
Smeltende sneeuw met de hand. Bron: Pixabay Met dit in gedachten is het te begrijpen waarom een sneeuwbal in de hand smelt (superieur beeld). Sneeuw absorbeert lichaamswarmte, wat voldoende is om de temperatuur van de sneeuw boven 0 ° C te verhogen.
De ijskristallen die aanwezig zijn in de sneeuw absorberen de rechterwarmte om te smelten en zodat hun watermoleculen een meer wanordelijke structuur aannemen. Terwijl de sneeuw smelt, zal het gevormde water de temperatuur niet verhogen, omdat alle hitte van de hand profiteert van de sneeuw om zijn fusie te voltooien.
- Verdamping

Verdamping is de verandering van toestand van een stof van de vloeibare toestand naar de gasvorming.
Doorgaan met het voorbeeld van het water, nu een handvol sneeuw in een pot plaatsen en het vuur aansteken, wordt waargenomen dat de sneeuw snel smelt. Terwijl water wordt verwarmd, beginnen kleine koolstofdioxidebellen en andere mogelijke gas onzuiverheden te vormen.
 Kokend water. Bron: Pixabay
Kokend water. Bron: Pixabay De warmte verwijdde moleculair de wanordelijke configuraties van het water, het uitbreiden van zijn volume en het verhogen van zijn stoomdruk; Daarom zijn er verschillende moleculen die ontsnappen aan het oppervlakproduct van toenemende verdamping.
Vloeibaar water verhoogt de temperatuur langzaam, vanwege de hoge specifieke warmte (4.184J/° C ∙ g) g). Er is een punt waarop de warmte die absorbeert het niet langer gebruikt om zijn temperatuur te verhogen, maar om de balans tussen vloeistof-damp te beginnen; Dat wil zeggen, het begint te koken en alle vloeistoff.
Dit is waar intense bubbel wordt waargenomen op het oppervlak van gekookt water (superieur beeld). De warmte die vloeibaar water absorbeert zodat de dampdruk van zijn beginnende bubbels gelijk is aan externe druk, wordt verdamping enthalpie genoemd (ΔHDapper)).
De rol van druk
De druk is ook beslissend in staatsveranderingen. Wat is het effect op verdamping? Dat bij grotere druk, hoe groter de warmte die water moet absorberen om te koken, en daarom wordt het boven 100 ° C verdampt.
Dit komt omdat de toename van de druk het moeilijk maakt om te ontsnappen uit watermoleculen van de vloeibare fase naar frisdrank.
Drukpotten gebruiken dit feit in hun voordeel om voedsel in water te verwarmen bij een temperatuur boven hun kookpunt.
Aan de andere kant heeft vloeibaar water, met een vacuüm of afname van de druk, een lagere temperatuur om te koken en door te gaan naar de gasfase. Met veel of weinig druk moet het water op het moment van koken zijn respectieve verdampingswarmte absorberen om zijn toestandsverandering te voltooien.
- Condensatie
Condensatie is de verandering van toestand van een stof van de gasvormige toestand naar de vloeibare toestand.
Kan u van dienst zijn: Galactose
Water is verdampt. Wat is het volgende? Waterdamp kan nog steeds de temperatuur verhogen en een gevaarlijke stroom worden die in staat is om ernstige brandwonden te veroorzaken.
Stel echter dat het afkoelt. Als? Het vrijgeven van warmte aan de omgeving, en bij vrijgegeven hitte wordt gezegd dat er een exotherme proces plaatsvindt.
Door warmte vrij te geven, beginnen de zeer energie -gasvormige moleculen te vertragen. Ook beginnen de interacties effectiever te worden naarmate de stoomtemperatuur daalt. Ten eerste zullen waterdruppeltjes, stoomcondensaat, gevolgd door grotere druppels die uiteindelijk worden aangetrokken door de zwaartekracht worden gevormd.
Om een bepaalde hoeveelheid stoom volledig te condenseren, moet je dezelfde energie loslaten, maar met een tegenovergestelde teken, bij ΔHDapper; dat wil zeggen, zijn condensatie -enthalpie ΔHCond. De omgekeerde, stoom-vloeistofbalans is dus stabiel.
Bevochtigde ramen
 Water -condensatie. Bron: Pexels
Water -condensatie. Bron: Pexels Condensatie kan worden waargenomen in huishoudelijke vensters zelf. In een koud weer botst de waterdamp in het huis met het raam, die door het materiaal een lagere temperatuur heeft dan andere oppervlakken.
Daar is het gemakkelijker voor stoommoleculen om te groeperen, waardoor een dunne witachtige laag gemakkelijk met de hand kan worden verwijderd. Omdat deze moleculen warmte vrijgeven (verwarmingsglas en lucht), beginnen ze meer vele clusters te vormen totdat ze de eerste druppels kunnen condenseren (bovenste afbeelding).
Wanneer de druppels hun grootte sterk verhogen, glijden ze door het raam en laten een spoor van water achter.
- Stolling
Stolling is de verandering van toestand van een stof van de vloeibare toestand naar de vaste toestand.

Solidificatie treedt op als gevolg van koeling; Met andere woorden, water bevriest. Om te bevriezen, moet het water dezelfde hoeveelheid warmte afgeven die ijs absorbeert om te smelten. Nogmaals, deze hitte wordt stolling of vriespunt en enthalpie genoemd, ΔHCong (-AHFus)).
Bij het koelen verliezen watermoleculen energie en worden hun intermoleculaire interacties sterker en directioneel. Als gevolg hiervan worden ze besteld dankzij hun waterstofbruggen en vormen ze de zo -gekalde ijskristallen. Het mechanisme waardoor ijskristallen een impact hebben op hun uiterlijk: transparant of wit.
 Ijssculptuur. Bron: Pixabay
Ijssculptuur. Bron: Pixabay Als ijskristallen zeer langzaam groeien, sluiten deze geen onzuiverheden af, zoals gassen die bij lage temperaturen worden opgelost in water. Aldus ontsnappen bubbels en kunnen ze niet communiceren met licht; En bijgevolg is er een ijs zo transparant als dat van een buitengewoon ijsbeeld (superieur beeld).
Hetzelfde dat gebeurt met ijs, kan gebeuren met elke andere stof die stolt door te koelen. Misschien is dit de meest complexe fysieke verandering in terrestrische omstandigheden, omdat verschillende polymorfen kunnen worden verkregen.
- Sublimatie
Sublimatie is de verandering van toestand van een stof van de vaste stof naar het gas.

Kan water sublim? Nee, althans niet in normale omstandigheden (t = 25 ° C, p = 1 atm). Voor sublimatie treedt op, dat wil zeggen de verandering van de vaste toestand van gas, de dampdruk van de vaste stof moet hoog zijn.
Evenzo is het essentieel dat hun intermoleculaire krachten niet erg sterk zijn, bij voorkeur als ze alleen bestaan uit dispersiekrachten
Het meest emblematische voorbeeld is solide jodium. Het is een kristallijne vaste stof van grijs-morele tonen, die een hoge stoomdruk heeft. Zo is het dat in zijn daad een paarse damp volgt, wiens volume en uitbreiding opmerkelijk zijn wanneer hij wordt opgeheven.
Kan u van dienst zijn: triethilamine: structuur, eigenschappen, gebruik en risico's Sublimatie van jodium. Bron: Belkina N V [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)], van Wikimedia Commons
Sublimatie van jodium. Bron: Belkina N V [CC door 4.0 (https: // creativeCommons.Org/licenties/door/4.0)], van Wikimedia Commons In het bovenste beeld wordt een typisch experiment getoond waar vaste jodium verdampt in een glazen container. Het is interessant en opvallend om te observeren hoe paarse dampen worden verspreid, en de geïnitieerde student kan de afwezigheid van vloeibare jodium verifiëren.
Dit is het belangrijkste kenmerk van sublimatie: er is geen aanwezigheid van een vloeibare fase. Het is ook endotherm, omdat de vaste stof warmte absorbeert om zijn stoomdruk te verhogen tot gelijk aan externe druk.
- Afzetting
 Iodo Crystal -afzet. Bron: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons
Iodo Crystal -afzet. Bron: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons De afzetting is de verandering van toestand van een stof van de gasvormige toestand naar de vaste toestand.
Parallel aan het jodiumsublimatie -experiment, heb je de verklaring dat. Afzetting is de tegenovergestelde verandering of overgang: de stof gaat van de gasvormige toestand naar de vaste stof zonder de vorming van een vloeibare fase.
Wanneer jodiumpaarse dampen in contact komen met een koud oppervlak, geven ze warmte vrij om het te verwarmen, verliezen ze energie en hergroeperen ze hun moleculen opnieuw in de grijsachtige vaste vaste stof (superieur beeld). Het is dan een exotherme proces.
De depositie wordt veel gebruikt voor de synthese van materialen waar ze doteren met metaalatomen door verfijnde technieken. Als het oppervlak erg koud is, is de warmte -uitwisseling ertussen en de stoomdeeltjes abrupt, waardoor de doorgang door de respectieve vloeibare fase wordt weggelaten.
De hitte of enthalpie van depositie (en niet Afzetting) is die van sublimatie (ΔHSub=- ΔHD.E.P)). In theorie kunnen talloze stoffen worden gesublimeerd, maar om dit te bereiken is het noodzakelijk om druk en temperaturen te manipuleren, naast het hebben van zijn P versus T -diagram; waarin hun verre mogelijke fasen kunnen worden gevisualiseerd.
Andere staatsveranderingen
Hoewel ze niet worden genoemd, zijn er andere staten van materie. Soms worden ze gekenmerkt door "een beetje van elk" te hebben, en daarom een combinatie ervan. Om ze te genereren, moeten drukken en temperaturen worden gemanipuleerd naar zeer positieve (grote) of negatieve (kleine) magnitudes.
Dus als de gassen bijvoorbeeld sterk worden verwarmd, verliezen ze hun elektronen en hun positief geladen kernen in dat negatieve getij zullen zijn wat bekend staat als plasma. Het is synoniem voor "elektrisch gas", omdat het een hoge elektrische geleidbaarheid presenteert.
Aan de andere kant, wanneer de temperatuur te veel daalt, kan de materie zich onverwacht zich gedragen; dat wil zeggen, ze vertonen unieke eigenschappen rond absolute nul (0 K).
Een van deze eigenschappen is overbodigheid en supergeleiding; evenals de vorming van Bose-Einstein-condensaat, waar alle atomen zich als één gedragen.
Zelfs sommige onderzoeken wijzen op fotonische materie. Daarin zijn de deeltjes van elektromagnetische straling, de fotonen, gegroepeerd om fotonische moleculen te vormen. Dat wil zeggen, het zou theoretisch massa massa geven.
Referenties
- Helmestine, Anne Marie, pH.D. (19 november 2018). Lijst met faseveranderingen tussen de toestand van de materie. Hersteld van: Thoughtco.com
- Wikipedia. (2019). Staat van materie. Opgehaald uit: in.Wikipedia.borg
- Dorling Kindersley. (2007). Veranderende staat. Hersteld van: Factmonster.com
- Meyers ami. (2019). Faseverandering: verdamping, condensatie, feesting, smelten, sublimatie en afzetting. Studie. Hersteld van: studie.com
- Bagley M. (11 april 2016). Materie: definitie en de vijf staat van materie. Hersteld van: livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- « Tweede wet van thermodynamica -formules, vergelijkingen, voorbeelden
- Kaliumjodide (ki) structuur, eigenschappen, verkrijgen, gebruik, risico's »

