Ceped warmteformules, hoe het te berekenen en oefeningen op te lossen

- 4884
- 725
- James Dach
Hij Afgestudeerde warmte Het is de overdracht van energie tussen twee lichamen bij verschillende temperaturen. Degene die een hogere temperatuur is, geeft warmte aan die wiens temperatuur lager is. Of een lichaam hitte oplevert of absorbeert, de temperatuur of de fysieke conditie kan variëren, afhankelijk van de massa en de kenmerken van het materiaal waarvan het is gemaakt.
Een goed voorbeeld is in een kopje stomende koffie. De lepel metaal waarmee suiker wordt geroerd. Als het voldoende tijd in de beker wordt achtergelaten, eindigt koffie en metalen theelepel. Sommige warmte zal zijn doorgegeven aan de omgeving, omdat het systeem niet geïsoleerd is.
 De koffie en de theelepel worden een tijdje in thermisch evenwicht. Bron: Pixabay.
De koffie en de theelepel worden een tijdje in thermisch evenwicht. Bron: Pixabay. Wanneer de temperaturen worden gekoppeld, de thermisch evenwicht.
Als dezelfde test werd gedaan met een plastic theelepel, zou het zeker merken dat het niet zo snel opwarmt als metaal, maar uiteindelijk zal het ook in balans raken met koffie en alles wat het omringt.
Dit komt omdat het metaal de warmte beter leidt dan het plastic. Aan de andere kant geeft koffie zeker hitte in een ander tempo dan warme chocolademelk of ander drankje. Vervolgens hangt de warmte toegewezen of geabsorbeerd door elk object af van welk materiaal of substantie wordt gemaakt.
[TOC]
Wat is en formules
Warmte verwijst altijd naar de stroom of doorvoer van energie tussen het ene object en het andere, vanwege het temperatuurverschil.
Daarom is er sprake van hitte toegewezen of geabsorbeerde warmte, omdat het op de een of andere manier door warmte of energie toe te voegen of te extraheren, het mogelijk is om de temperatuur van een element te wijzigen.
Het wordt meestal de hoeveelheid warmte genoemd die het heetste object oplevert. Deze waarde is evenredig met de massa van dit object. Een lichaam met geweldige massa is in staat om meer warmte op te geven dan een andere van mindere massa.
Kan u van dienst zijn: Millikan Experiment: procedure, uitleg, belangHet temperatuurverschil AT
Een andere belangrijke factor bij de berekening van de toegewezen warmte is het temperatuurverschil dat het object dat de hitte oplevert, ervaart. Het wordt aangeduid als δT En het wordt zo berekend:
Δt = tF - Tof
Ten slotte hangt de hoeveelheid toegewezen warmte ook af van de aard en kenmerken van het object, die kwantitatief zijn samengevat in een constante genoemde Specifieke warmtewarmte, aangeduid als C.
Dus eindelijk is de uitdrukking voor de toegewezen warmte als volgt:
QBekledend = - m.C.ΔT
De opbrengst wordt gesymboliseerd met een negatief teken.
De specifieke warmte- en warmtecapaciteit van een stof
De specifieke warmte is de hoeveelheid warmte die nodig is om de temperatuur van 1 g stof bij 1 ° C te verhogen. Het is een intrinsieke eigenschap van het materiaal. De eenheden in het internationale systeem zijn: Joule/kg . K (Joule tussen kilogram x temperatuur in graden Kelvin).
De warmtecapaciteit C is een gekoppeld, maar iets ander concept, omdat de massa van het object tussenkomt. Warmtecapaciteit wordt als volgt gedefinieerd:
C = MC
Zijn eenheden in s.Je. Ze zijn joule/k. Zodat de afgestudeerde warmte ook gelijkwaardig kan worden uitgedrukt als:
Q = -c. ΔT
Hoe het te berekenen?
Om de warmte te berekenen die door een object is toegewezen, is het vereist om het volgende te weten:
- De specifieke warmte van de stof die de hitte geeft.
- De massa van genoemde substantie
- De laatste temperatuur om te verkrijgen
De specifieke warmtewaarden voor veel materialen zijn experimenteel bepaald en zijn beschikbaar in tabellen.
Calorimetrie
Als deze waarde niet bekend is, is het mogelijk om deze te verkrijgen met behulp van een thermometer en water in een thermisch geïsoleerde container: de calorimeter. Een schema van dit apparaat wordt weergegeven in de figuur die hoort bij oefening 1.
Een monster van de stof wordt ondergedompeld bij een bepaalde temperatuur in een hoeveelheid water die eerder heeft gemeten. De eindtemperatuur wordt gemeten en met de verkregen waarden wordt de specifieke warmte van het materiaal bepaald.
Kan u van dienst zijn: Willekeurige fout: formule en vergelijkingen, berekening, voorbeelden, oefeningenAls u het resultaat vergelijkt met tabelwaarden, kan het bekend zijn welke stof het is. Deze procedure wordt genoemd calorimetrie.
De warmtebalans wordt uitgevoerd door het behoud van energie:
Q Bekledend + Q geabsorbeerd = 0
Opgeloste oefeningen
Oefening 1
Een 0 stuk van 0.35 kg bij een temperatuur van 150 ºC in 500 ml water bij een temperatuur van 25 º C. Vinden:
a) de uiteindelijke evenwichtstemperatuur
b) Hoeveel warmtestromen in dit proces?
Gegevens
Ckoper = 385 J/kg . ºC
CWater = 4180 J/kg . ºC
Waterdichtheid: 1000 kg/m3
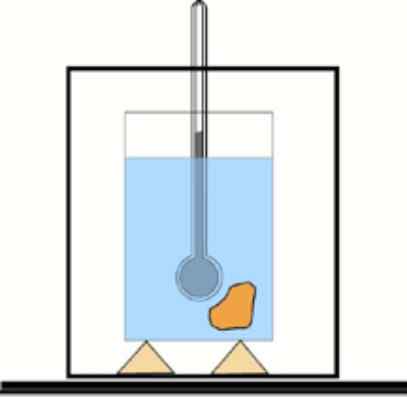 Basic calorimeterschema: een container met geïsoleerd water en een thermometer om temperatuurveranderingen te meten. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Basic calorimeterschema: een container met geïsoleerd water en een thermometer om temperatuurveranderingen te meten. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Oplossing
a) Koper geeft warmte terwijl water het absorbeert. Aangezien het systeem wordt beschouwd als gesloten, komen alleen water en monster tussenbeide in de warmtebalans:
Q Bekledend = Q geabsorbeerd
Aan de andere kant is het noodzakelijk om de massa van 500 ml water te berekenen:
500 ml = 0.5 L = 0.0005 m3
Met deze gegevens wordt de massa van het water berekend:
massa = dichtheid x volume = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
De warmtevergelijking wordt in elke stof verhoogd:
QBekledend = -mkoper . Ckoper. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ºC) = -134.75 (TF - 150) J
Qgeabsorbeerd = mwater . Cwater. ΔT = 0.5 kg . 4186 J/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Equalizing van de resultaten die u hebt:
2093 (TF - 25) = -134.75 (TF - 150)
Het is een lineaire vergelijking met een onbekende, wiens oplossing is:
TF = 32.56 ºC
b) De hoeveelheid warmte die stroomt, is de toegewezen warmte of de geabsorbeerde warmte:
Q Bekledend = - 134.75 (32.56 - 150) J = 15823 J
Q geabsorbeerd = 2093 (32.56 - 25) J = 15823 J
Oefening 2
Een koperen stuk van 100 g wordt verwarmd in een oven tot een T -temperatuurof En dan wordt het geïntroduceerd in een koperen calorimeter van 15 g die 200 g water bevat bij 16 º C. De eindtemperatuur eenmaal in evenwicht is 38 º C. Wanneer de calorimeter en de inhoud ervan worden gewogen, blijkt dat ik zijn verdampt.2 g water wat was de begintemperatuur tof?
Kan u van dienst zijn: Worm hole: geschiedenis, theorie, types, formatieGegevens: de latente warmte van de waterdamping is Lv = 2257 kJ/kg
Oplossing
Deze oefening verschilt van de vorige, omdat moet worden aangenomen dat de calorimeter ook warmte absorbeert. De warmte toegewezen door het koperen stuk wordt in al het volgende geïnvesteerd:
- Verwarm het water uit de calorimeter (200 g)
- Verwarm het koper waarvan de calorimeter is gemaakt (150 g)
- Verdamp 1.2 gram water (voor een faseverandering heb je ook energie nodig).
QBekledend = -100 X 1 x 10 -3 kg. 385 J/kg . ºC. (38 - Tof ) ºC = -38.5. (38 - Tof) J
Q door hem geabsorbeerd calorimeter = Q geabsorbeerd door water + Q verdamping + Q geabsorbeerd door koper
0.2 kg .4186 J/kg ºC .(38 - 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 J
Daarom:
-38.5. (38 - Tof) = 22397.3
Tof = 619.7 ºC
De hitte die nodig is om de 1 te dragen had ook in overweging kunnen worden genomen.2 g water tot 100 º C, maar het is een vrij kleine hoeveelheid vergeleken.
Referenties
- Giancoli, D. 2006. Fysica: principes met toepassingen. 6e. ED. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Natuurkunde: een blik op de wereld. 6ta Afgekort editie. Cengage leren. 156 - 164.
- Rex, a. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitaire natuurkunde met moderne natuurkunde. 14e. ED. Deel 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9NA Cengage leren.
- « Gevoelig warmteconcept, formules en oefeningen opgelost
- Factoriële rig definitie, formules en oefeningen »

