Butanale structuur, eigenschappen, gebruik en risico's
- 4083
- 1245
- Kurt Aufderhar Jr.
Hij Butanal Het is een open keten aldehyde, bestaande uit vier koolstofatomen, en is analoog aan de butaan; Het is in feite de tweede meest geoxideerde vorm van butaankoolwaterstof na boterzuur. De moleculaire formule is cho3Ch2Ch2Cho, waar -cho de formilgroep is.
Deze aldehyde, een van de lichtste, bestaat uit een transparante, brandbare en minder dichte vloeistof dan water. Bovendien is het oplosbaar in water en mengbaar met de meeste organische oplosmiddelen; Daarom kan het worden gebruikt om organische mengsels met één fase te hebben.
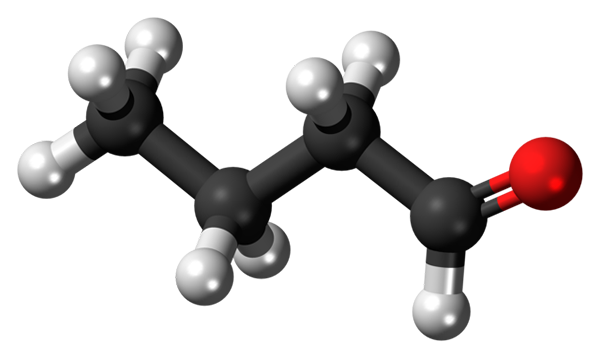
 Butanal of butiraldehyde molecuul. Bron: Jynto [CC0]
Butanal of butiraldehyde molecuul. Bron: Jynto [CC0] De aanwezigheid van de carbonylgroep (die van de rode bol, superieur beeld) geeft chemische polariteit aan het butanale molecuul, en daarom het vermogen om de dipool-dipolo-interactie tussen zijn moleculen te ervaren; Hoewel er geen waterstofbruggen tussen worden gevormd.
Dit brengt als gevolg dat het butanale kook- en fusiepunten groter zijn dan butaan, maar minder dan die gepresenteerd door n-boutylalcohol.
Butanal wordt gebruikt als oplosmiddel en is intermediair om talloze producten te verkrijgen; zoals versnellers van de vulkanisatie van rubbers, harsen, farmaceutische en agrochemische producten.
Butanal is een giftige verbinding dat inademing ontsteking kan veroorzaken van de bovenste luchtwegen, de bronchiën en het longoedeem dat zelfs fatale gevolgen kan hebben.
[TOC]
Butanale structuur
Er is zojuist gezegd dat de Formil -groep, -CH. Als gevolg hiervan kunnen hun moleculen met elkaar communiceren via dipool-dipolo-krachten.
Kan u van dienst zijn: roterende droger: bediening, waarvoor is het voor, onderdelen, toepassingenIn het bovenste beeld wordt het getoond, met een model van bollen en staven, dat het butanale molecuul een lineaire structuur heeft. De koolstof -cho van de groep heeft SP -hybridisatie2, Terwijl de resterende koolstofatomen3.
Niet alleen dat, maar het is ook flexibel, en hun links kunnen op hun eigen assen roteren; En dus worden verschillende conformaties of conformers gegenereerd (dezelfde verbinding, maar met hun geroteerde links).
Conformeros
De volgende afbeelding legt dit punt het beste uit:
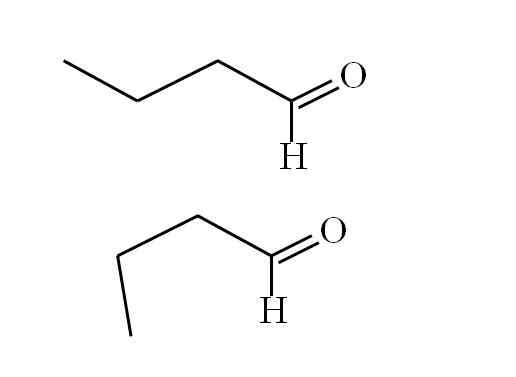 Butanal conform. Bron: Gabriel Bolívar.
Butanal conform. Bron: Gabriel Bolívar. De eerste conformer (de superieur) komt overeen met het molecuul van het eerste beeld: de methylgroep aan de linkerkant, -CH3, en de groep -cho, bevinden zich in anti -parallelle posities; De ene wijst omhoog, en de andere respectievelijk naar beneden.
Ondertussen komt de tweede conformer (de onderste) overeen met het molecuul met de -CH3 en de -Ho in overschaduwde posities; dat wil zeggen, beide wijzen in dezelfde richting.
Beide conformers zijn snel uitwisselbaar en daarom is het butanale molecuul roterend en trilt het constant; En voegde eraan toe dat hij een permanente dipool heeft, dit maakt zijn interacties sterk genoeg om te koken op 74.8ºC.
Eigenschappen
Chemische namen
-Butanal
-Butiraldehyde
-1-Butanal
-Butiraal
-N-butiraldehyde.
Moleculaire formule
C4H8Of ch3Ch2Ch2Cho.
Fysiek uiterlijk
Het is een duidelijke, transparante vloeistof.
Geur
Karakteristieke geur, acre, aldehyde.
Kookpunt
167 ºF bij 760 mmHg (74,8 ºC).
Smeltpunt
-146 ºF (-96,86 ºC).
ontstekingspunt
-8 ºF (-22 ºC) gesloten glas.
Oplosbaarheid in water
7 g/100 ml bij 25 ºC.
Oplosbaarheid in biologische oplosmiddelen
Mengbaar met ethanol, ether, ethylacetaat, aceton, tolueen en vele andere organische oplosmiddelen.
Dikte
0,803 g/cm3 bij 68 ºF.
Kan u van dienst zijn: nitraten: eigenschappen, structuur, nomenclatuur, trainingDampdichtheid
2,5 (in luchtrelatie die gelijk is aan 1).
Dampdruk
111 mmHg bij 25 ºC.
Zelfstudie
446 ºF. 425 ºF (21,8 ºC).
Smurrie
0,45 cpoise bij 20 ºC.
Verbranding warmte
2479,34 kJ/mol bij 25 ° C.
Verdampingswarmte
33,68 kJ/mol bij 25 ° C.
Oppervlaktespanning
29,9 Dina/cm A 24 ºC.
Geurdrempel
0,009 ppm.
Brekingsindex
1.3843 tot 20 ºC.
Dipolair moment
2.72 D.
Golflengten (λ) van maximale absorptie in water
225 nm en 282 nm (ultraviolet licht).
Polymerisatie
Butanal kan polymeriseren in contact met alkalis of zuur, zijnde gevaarlijke polymerisatie.
Reactiviteit
Bij blootstelling aan de geoxideerde lucht, het vormen van boterzuur. Bij een temperatuur van 230 ° C is de Butanal spontaan ontstoken met de lucht.
Aldolische condensatie
Twee butanale moleculen kunnen op elkaar reageren, in aanwezigheid van KOH en een temperatuur van 6-8 ºC, om de verbinding 2-ethyl-3-hydroxyhexanol te vormen. Dit samengestelde type wordt aldol genoemd, omdat het een aldehyde -groep en een alcoholische groep in zijn structuur heeft.
Synthese
Butanal kan optreden door katalytische dehydrogenering van N-butylalcohol; de katalytische hydrogenering van het crotonaldehyde; en propyleen hydroformilatie.
Toepassingen
Industriëlen
-Butanal is een industrieel oplosmiddel, maar het is ook intermediair in de synthese van andere oplosmiddelen; Bijvoorbeeld 2-ethylhexanol, N-butanol en trimethylpropaan.
-Het wordt ook gebruikt als intermediair bij de uitwerking van synthetische harsen, waaronder butirale polyvinil; versnellers van de vulkanisatie van rubber; productie van farmaceutische producten; producten voor gewasbescherming; pesticiden; antioxidanten; Brinkelende assistenten.
-Butanal wordt gebruikt als grondstof voor de uitwerking van synthetische aroma's. Bovendien wordt het gebruikt als een voedselsmaakmiddel.
Het kan u van dienst zijn: natriumbromide (NABR)Anderen
-Bij de mens wordt Butanal gebruikt als een biomarker die indicatief is voor oxidatieschade, ervaren door lipiden, eiwitten en nucleïnezuren.
-Het werd experimenteel gebruikt, samen met formaline en gluterdehyde, om te proberen het verzachtende door rundvleeshelmen te verminderen, vanwege blootstelling aan water, urine en ontlasting van runderen zelf. Experimentele resultaten waren positief.
Risico's
Het butanal is destructief voor de slijmvliesmembranen van het bovenste luchtwegen, evenals voor huid- en ogenweefsels.
Door contact met de huid produceert roodheid en brandwonden. In de ogen worden dezelfde laesies geproduceerd, vergezeld van pijn en schade aan het oculaire weefsel.
Butanale inademing kan ernstige gevolgen hebben, omdat het kan produceren in de strottenhoofd en ontstekingen en oedeem bronchialen; Terwijl het in de longen is, produceert het chemische longontsteking en longoedeem.
De tekenen van overmatige blootstelling omvatten: Aards -sensaties op de bovenste luchtwegen, hoest, piepende ademhaling, dat wil zeggen, emissie van fluitje tijdens het ademen; laryngitis, gebrek aan adem, hoofdpijn, misselijkheid en ook braken.
Inademing kan fataal zijn als gevolg van de spasmen van de reparatiereegen.
Butanale inname veroorzaakt een gevoel van "branden" op spijsverteringsroutes: mondholte, keelholte, slokdarm en maag.
Referenties
- Morrison, r. T. En Boyd, r. N. (1987). Organische chemie. (5ta Editie.)). Redactionele addison-wesley IberoAmericana.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Pubchem. (2019). Butanal. Hersteld van: pubchem.NCBI.NIM.NIH.Guv
- Wikipedia. (2019). Butanal. Hersteld van: is.Wikipedia.borg
- Chemisch boek. (2017). Butanal. Hersteld van: chemisch boek.com
- BASF. (Mei 2017). N-butyraldehyde. [PDF]. Opgehaald uit: oplosmiddelen.BASF.com
- « Primaire koolstofkarakteristieken, typen en voorbeelden
- Integrale onderwijskarakteristieken en hoe deze te bereiken »

