Lithiumbromidestructuur, eigenschappen, gebruik, risico's
- 3756
- 814
- Miss Herman Russel
Hij Lithiumbromide Het is een neutraal zout van een alkalisch metaal waarvan de chemische formule bibliotheek is. De formule geeft aan dat zijn kristallijne vaste stof bestaat uit Li -ionen+ en br- In een verhouding van 1: 1. Je kristallen zijn wit of licht beige. Het is erg oplosbaar in het water en het is ook een nogal hygroscopisch zout.
Deze laatste eigenschap maakt het gebruik ervan mogelijk als een droogmiddel in airconditioning en koelsystemen. Evenzo werd lithiumbromide gebruikt sinds het begin van de 20e eeuw bij de behandeling van bepaalde psychische stoornissen, waardoor het gebruik ervan door ongepast gebruik van zout wordt opgelaten.
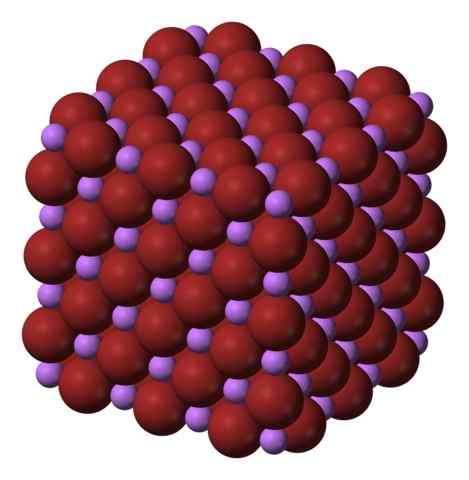
 Kubieke kristallijne structuur van de bibliotheek. Bron: Benjah-bmm27 via Wikipedia.
Kubieke kristallijne structuur van de bibliotheek. Bron: Benjah-bmm27 via Wikipedia. De bibliotheek wordt geproduceerd door de behandeling van lithiumcarbonaat, li2CO3, met bromhyterinezuur. Na opwarming van het medium, neerslaat in de waterige oplossing als een hydraat.
Dit zout irriteert de huid en ogen door contact, terwijl de irritatie van ademhalingskanalen door inademing wordt geproduceerd. De inname van lithiumzouten kan misselijkheid, braken, diarree en duizeligheid veroorzaken.
[TOC]
Lithiumbromidestructuur
De bibliotheekformule maakt duidelijk dat het aandeel Li/BR gelijk is aan 1; Voor elke kation li+ Er moet een branion zijn- tegenhanger. Daarom moet dit aandeel constant worden gehouden in elke hoek van het bibliotheekkristal.
De ionen li+ en br- Ze trekken elkaar aan, waardoor de afstotingen tussen gelijke belastingen worden verminderd, om een kubisch kristal type edelsteen te veroorzaken; Dit is isomorf voor NaCl (superieure afbeelding). Merk op dat de hele set een kubieke geometrie heeft.
In dit kristal, de li+ Ze zijn kleiner en hebben een lichte violette kleur; Terwijl de Br- Ze zijn meer omvangrijk en een intense bruine kleur. Opgemerkt wordt dat elk ion zes buren heeft, wat hetzelfde is als zeggen dat ze een octaëdrische coördinatie presenteren: bibliotheek6 of li6Br; Als de unitaire cel echter wordt overwogen, blijft de aandeel Li/BR over 1.
Kan u van dienst zijn: kristallijne structuurDit is de kristallijne structuur die bij voorkeur wordt aangenomen door de bibliotheek. Het kan echter ook andere soorten kristallen vormen: Wurzita, indien kristalliseert bij lage temperaturen (-50 ° C) op een substraat; o Kubiek gecentreerd op het lichaam of het CSCL -type, als het kubieke glaszout onder hoge druk wordt onderworpen.
Hydraten en glas
Het bovenstaande is van toepassing op het bibliotheek wat betreft. Dit zout is hygroscopisch en kan daarom het vocht van de omgeving absorberen, waardoor watermoleculen in hun eigen kristallen worden afgewisseld. Dus bibliotheek ontstaan NH -hydraten2Of (n = 1, 2, 3 ..., 10). Voor elk hydraat is de kristallijne structuur anders.
Kristallografische studies hebben bijvoorbeeld vastgesteld dat de bibliotheek h2Of een structuur van het perovskita -type overnemen.
Wanneer deze hydraten in waterige oplossing zijn, kunnen ze overlopen en zichzelf vitrificeren; Dat wil zeggen, ze nemen een kristallijne, maar moleculair wanordelijke structuur aan. Onder dergelijke omstandigheden worden waterstofbruggen van water behoorlijk belangrijk.
Eigenschappen
Molecuulgewicht
88.845 g/mol.
Verschijning
Witte kristallijne vaste stof of licht beige.
Geur
Toilet.
Smeltpunt
552 ºC (1.026 ºF, 825 K).
Kookpunt
1.256 ºC (2.309 ºF, 1.538 K).
Oplosbaarheid in water
166,7 g/100 ml bij 20 ° C. Let op uw hoge oplosbaarheid.
Oplosbaarheid in biologische oplosmiddelen
Oplosbaar in methanol, ethanol, ether en aceton. Enigszins oplosbaar in pyridine, aromatische verbinding en minder polair dan de vorige.
Brekingsindex (ηd)
1.784.
Calorische capaciteit
51.88 J/Mol · K.
Standaard molaire entropie (sθ 298)
66.9 J/Mol · K.
ontstekingspunt
1.265 ºC. Wordt als niet -vlambaar beschouwd.
Stabiliteit
Stal. De anhydra -vorm is echter extreem hygroscopisch.
Ontleding
Wanneer het ontleedt door opwarming, veroorzaakt het lithiumoxide.
Kan u van dienst zijn: chlorogeenzuurpH
Tussen pH 6 en 7 in waterige oplossing (100 g/l, 20 ºC).
Reactiviteit
Lithiumbromide is niet reactief onder normale omgevingscondities. U kunt echter intense reacties ervaren met sterke zuren wanneer de temperatuur toeneemt.
Bij het oplossen van water is er een toename van de temperatuur, veroorzaakt door een negatieve enthalpie van hydratatie.
Productie
Libran vindt plaats door lithiumhydroxide of lithiumcarbonaat met bromhyterinezuur te reageren in een neutralisatiereactie:
Li2CO3 + Hbr => bibliotheek +co2 + H2OF
Lithiumbromide wordt verkregen als een hydraat. Om watervrij vorm te verkrijgen, is het noodzakelijk om het gehydrateerde zout onder vacuüm te verwarmen.
Nomenclatuur
De naam 'lithiumbromide' is voortgekomen uit een metaalhalogenide, genoemd volgens de voorraadnomenclatuur. Andere namen, even geldig maar minder gebruikt, zijn de lithiummonobromure, volgens de systematische nomenclatuur; en de lithische bromide (de unieke valentie van +1 voor lithium), volgens de traditionele nomenclatuur.
Toepassingen
Gedescanteerd
De bibliotheek is een hygroscopisch zout en vormt een geconcentreerde pekel die in een breed temperatuurbereik luchtvocht kan absorberen. Deze pekel wordt gebruikt als een droogmiddel in airconditioning en koelsystemen.
Vezels
Het wordt gebruikt om het volume wol, haar en andere biologische vezels te vergroten.
Farmaceutische adducten
De bibliotheek vormt adducten met sommige farmaceutische verbindingen, die zijn actie moduleren. Een adduct is de combinatie door twee of meer moleculen te coördineren, zonder een structurele wijziging van een van de verenigde moleculen.
Kalmerend middel
Lithiumbromide werd in het begin gebruikt als kalmerend middel bij bepaalde psychische stoornissen, stopte met het gebruik in 1940. Momenteel wordt lithiumcarbonaat gebruikt; Maar in elk geval is lithium het element dat de therapeutische werking uitgeoefent in beide verbindingen.
Het kan u van dienst zijn: Plumbose -oxide (PBO): formule, eigenschappen, risico's en gebruikLithium wordt gebruikt bij de behandeling van bipolaire stoornis, die nuttig is geweest bij de controle van manische afleveringen van de aandoening. Men denkt dat lithium de activiteit van excitatoire neurotransmitters remt, zoals dopamine en glutaminezuur.
Aan de andere kant neemt de activiteit van het remmende systeem gemedieerd door de neurotransmitter gamma-amino-boterzuur (GABA) (GABA) toe (GABA). Deze acties kunnen deel uitmaken van de basis van de therapeutische werking van lithium.
Risico's
Neem contact op met toxiciteit
Cutane irritatie en sensibilisatie, allergieën. Ernstige oogletsels of oogirritatie, op de luchtwegen, neusgaten en keel.
Inname
De belangrijkste symptomen als gevolg van lithiumbromide -inname zijn: gastro -intestinale aandoeningen, braken en misselijkheid. Andere nadelige effecten op de inname van zout omvatten agitatie, spasmen en bewustzijnsverlies.
De aandoening die bekend staat als "bromisme" kan optreden met lithium -bromide -dosis groter dan 225 mg/dag.
In het bromisme kunnen enkele van de volgende symptomen en tekenen optreden: verergering van acne en verlies van eetlust, tremoren, spraakproblemen, apathie, zwakte en maniakale agitatie.
Referenties
- Chemische formulering. (2019). Lithiumbromide. Hersteld van: Quimica -formulering.com
- David C. Johnson. (10 juli 2008). Nieuwe bestelling voor lithiumbromide. Natuur. doen.org/10.1038/454174A
- Aayushi Jain & R.C. Dixit. (S.F.)). Structurele faseovergang in lithiumbromide: effect van druk en temperatuur. [PDF]. Hersteld van: ncpcm.in
- Takamuku et al. (1997). Röntgenfoto difffractie-onderzoeken naar supercooled waterige lithiumbromide- en lithiumjodide-oplossingen. Afdeling Chemie, Faculteit Wetenschap, Fukuoka University, Nanakuma, Jonan-Ku, Fukuoka 814-80, Japan.
- Nationaal centrum voor biotechnologie -informatie. (2019). Lithiumbromide. PubChem -database, CID = 82050. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Lithiumbromide. Opgehaald uit: in.Wikipedia.borg
- Royal Society of Chemistry. (2019). Lithiumbromide. Chem. Hersteld van: Chemspider.com
- « Alkyl halogenuros eigenschappen, het verkrijgen van voorbeelden
- Mexico in de 18e -eeuwse handelingen en sociaaleconomische veranderingen »

