Alkyl halogenuros eigenschappen, het verkrijgen van voorbeelden
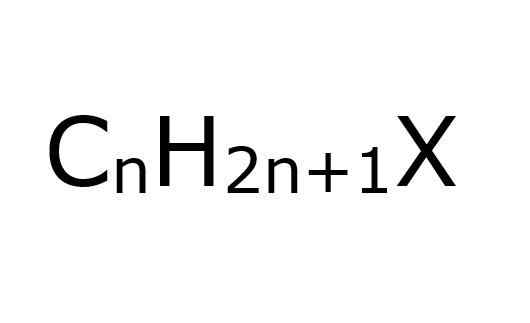
- 2012
- 280
- Alton D'Amore
De alkylhalogenuros Het zijn organische verbindingen waarin een koolstofatoom met SP -hybridisatie3 Een halogeen is covalent gekoppeld (f, cl, br, i). Vanuit een ander perspectief is het handig, om te vereenvoudigen, aan te nemen dat ze haloalcanos zijn; Dit zijn, voor degenen die enkele H -halogeenatomen zijn vervangen.
Zoals de naam al aangeeft, moeten halogeenatomen worden gekoppeld aan alquilicale groepen, R, om te worden beschouwd als van dit type halogenide; Hoewel structureel ze kunnen worden vervangen of vertakt en aromatische ringen hebben, en toch een alkylhalogenide blijven.
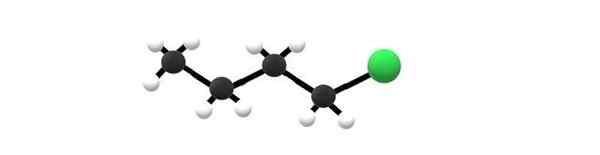 1-chloorobutano-molecuul, een voorbeeld van een alkylhalogenide. Bron: Gabriel Bolívar.
1-chloorobutano-molecuul, een voorbeeld van een alkylhalogenide. Bron: Gabriel Bolívar. Hierboven heb je het 1-chloorobutano-molecuul, dat overeenkomt met een van de eenvoudigste alkylhalogeniden. Het is te zien dat al hun koolstofatomen eenvoudige banden hebben en ook spybridisatie hebben3. Daarom is de groene bol, overeenkomend met het atoom van CL, gekoppeld aan een skelet afgeleid van de butane alkane.
Voorbeelden nog eenvoudiger dan 1-chloorobutano zijn die afgeleid van methaangas: de kleinste koolwaterstof van allemaal.
Van zijn ChO -molecuul4 U kunt H -atomen vervangen door, om te zeggen, jodium. Als een H wordt vervangen, zal de CH zijn3I (yodomethaan of methyljodide). Wanneer twee H wordt vervangen, zal de CH zijn2Je2 (Diyodomethaan of methyleenjodide). Gevolgd en ten slotte vervang ik alle h geven chi3 (jodoform) en CI4 (Carbon Tetrayoduro).
Huurhalogenuros worden gekenmerkt door zeer reactief te zijn en, met de meest elektronegatieve atomen van het periodiek systeem, is het intuïtief dat door mechanismen symfines een invloed uitoefenen op biologische matrices.
[TOC]
Eigenschappen van alkylhalogenuros
De eigenschappen van deze familie van verbindingen zijn afhankelijk van de moleculaire structuren. In vergelijking met die van hun alkanen zijn opmerkelijke verschillen echter veroorzaakt door het simpele feit dat er C-X-links zijn (x = halogeenatoom).
Dat wil zeggen, C-X-links zijn verantwoordelijk voor elk verschil of gelijkenis tussen een of meer alkylhalogenuros.
Om te beginnen zijn C-H-links bijna apolair, gezien het lage elektronegativiteitsverschil tussen C en H; In plaats daarvan hebben C-X-links een permanent dipoolmoment, omdat halogenen meer elektronegatief zijn dan koolstof (vooral fluor).
Aan de andere kant zijn sommige halogenen licht (F en CL), terwijl andere zwaar zijn (Br en I). De atomaire massa's vormen ook verschillen binnen C-X-links; En op zijn beurt, direct in de eigenschappen van halogenide.
Daarom is het toevoegen van halogenen aan een koolwaterstof gelijk aan het vergroten van zijn polariteit en moleculaire massa; Het is hetzelfde om het (tot op zekere hoogte minder vluchtig te maken), minder ontvlambaar en het vergroten van zijn kokende of fusiepunten.
Kook- en fusiepunten
Het bovenstaande wordt in toenemende volgorde de grootte en daarom het gewicht van de verschillende halogenen getoond:
F < Cl < Br < I
Dan wordt verwacht dat alkylhalogeniden die F -atomen bevatten lichter zijn dan degenen die atomen van BR of i hebben.
Sommige halogenuros afgeleid van methaan worden bijvoorbeeld beschouwd:
Ch3F < CH3Klet < CH3BR < CH3Je
Ch2F2 < CH2Klet2 < CH2BR2 < CH2Je2
En zo verder voor het andere derivatenproduct van een hogere halogenatiegraad. Merk op dat de volgorde wordt gehandhaafd: fluorhalogenuros zijn lichter dan jodium. Niet alleen dat, maar ook de kook- en fusiepunten gehoorzamen deze volgorde ook; De RF kookt bij lagere temperaturen dan de RI (r = cho3, in dit geval).
Kan u van dienst zijn: aromatische elektrofiele substitutie: mechanisme en voorbeeldenEvenzo zijn al die vloeistoffen kleurloos, omdat in hun C-X-bindingen de elektronen niet kunnen absorberen of fotonen vrijgeven om andere energieniveaus te reizen. Naarmate ze zwaarder worden, kunnen ze echter kristalliseren en kleuren vertonen (zoals jodoform doet, Chi3)).
Polariteit
C-X-koppelingen verschillen van polariteit, maar in de omgekeerde volgorde van hierboven:
C-F> C-Cl> C-BR> C-I
Daarom zijn C-F-links meer polair dan C-I-links. Omdat ze polairer zijn, hebben RF-halogenuros de neiging om te interageren via dipool-dipolo-krachten. Ondertussen zijn hun dipoolmomenten in de RBR of RI -halogenuros zwakker en krijgen de interacties die worden beheerst door de dispersietroepen van Londen.
Oplosmiddelkracht
Omdat alkylhalogeniden meer polair zijn dan de alkanen waaruit ze afleiden, vergroten ze hun vermogen om een groter aantal organische verbindingen op te lossen. Het is om deze reden dat ze de neiging hebben om betere oplosmiddelen te zijn; Hoewel het niet betekent dat ze de alkanen in alle toepassingen kunnen vervangen.
Er zijn technische, economische, ecologische en prestatiecriteria om een gehalogeneerd oplosmiddel te verkiezen boven een alkaan.
Nomenclatuur
Er zijn twee manieren om een alkylhalogenide te noemen: door zijn gemeenschappelijke naam, of door zijn systematische naam (IUPAC). Gemeenschappelijke namen zijn meestal comfortabeler om te gebruiken wanneer RX eenvoudig is:
Chcl3
Chloroform: gemeenschappelijke naam
Methyl- of trichloormethaan trichloride: IUPAC -naam.
Maar de systematische namen hebben de voorkeur (en de enige optie), wanneer ze vertakte structuren hebben. Ironisch genoeg zijn gemeenschappelijke namen opnieuw nuttig wanneer structuren te ingewikkeld zijn (zoals die die in de laatste sectie zullen worden gezien).
De regels om een verbinding te noemen volgens het IUPAC -systeem zijn hetzelfde als voor alcoholen: de hoofdketen is geïdentificeerd, die de langste of de meest vertakte is. Vervolgens worden koolstoffen weergegeven vanaf het einde dat het dichtst bij substituenten of gevolgen in de buurt komt, waardoor de alfabetische volgorde wordt genoemd.
Voorbeeld
Om het te illustreren, heb je het volgende voorbeeld:
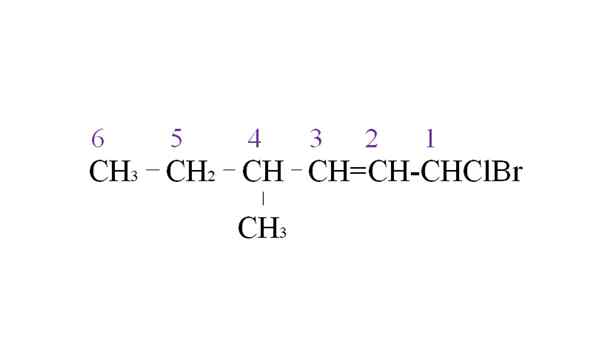 Huur halogenide als een voorbeeld van de nomenclatuur. Bron: Gabriel Bolívar.
Huur halogenide als een voorbeeld van de nomenclatuur. Bron: Gabriel Bolívar. De eerste tak is de methylgroep in de C-4; Maar met een dubbele binding deze eerdere prioriteit boven de uitgewerkte regel. Om die reden begint de langste keten van rechts te worden vermeld, geleid door een koolstofatoom gekoppeld aan twee halogenen: CL en BR.
Met de opsomming worden de substituenten in alfabetische volgorde genoemd:
1-broom-1-clor-4-methyl-2-hexen.
Het verkrijgen van
Om alkylhalogeniden te verkrijgen, moeten moleculen worden onderworpen aan een halogeneringsproces; dat wil zeggen, om halogeenatomen in hun structuren op te nemen, vooral aan een atoom voor een SP A -koolstof3.
Er zijn twee methoden om ze te verkrijgen of te synthetiseren: door ultraviolette straling door een vrij radicaal mechanisme, of door het toevoegen van hydracests of halogenen.
Halogenering met lichte of ultraviolette straling
De eerste, de minst geschikte en met de ergste opbrengsten, bestaat uit bestralen van alkanen met ultraviolette straling (HV) In aanwezigheid van een halogeen. De vergelijkingen voor de chlorering van methaan worden bijvoorbeeld getoond:
Ch4 + Klet2 => Ch3Cl + HCl (onder Ultraviolet Light)
Ch3Cl + cl2 => Ch2Klet2 + HCl
Ch2Klet2 + Klet2 => Chcl3 + HCl
Chcl3 + Klet2 => CCL4 + HCl
De vier verbindingen (ch3CL, CH2Klet2, Chcl3 en CCL4) Ze worden gevormd en daarom is er een mengsel, dat kan worden onderworpen aan fractionele destillatie. Deze methode is echter niet erg praktisch en het heeft de voorkeur om hun toevlucht te nemen tot organische synthese.
Kan u bedienen: fenylacezuur: structuur, eigenschappen, gebruik, effectenEen ander voorbeeld is dat van de n-hexane bromatie:
Ch3Ch2Ch2Ch2Ch2Ch3 + BR2 => Ch3(BR) Chch2Ch2Ch2Ch3 + HBR
Nogmaals, in deze reactie wordt de lichte of ultraviolette straling gebruikt om de vorming van vrije radicalen te bevorderen. De broom, zoals een intense rode vloeistof, wordt verkleurd terwijl deze reageert, waardoor een rode naar kleurrijke kleurverandering wordt waargenomen wanneer de 2-broomhexan.
Toevoeging van hydracests of halogenen aan alkenen
De tweede methode voor het verkrijgen van alkylhalogenuros is het behandelen van alcoholen (ROH) of alkenen (r2C = Cr2) Met Hydrace. Hydracides hebben een HX algemene formule (HF, HCL, HBR en HI). Een voorbeeld wordt getoond met behulp van ethanol voor elk van hen:
Ch3Ch2Oh + hf => ch3Ch2F + H2OF
Ch3Ch2Oh + hcl => ch3Ch2Cl + H2OF
Ch3Ch2OH + HBR => CH3Ch2Br + H2OF
Ch3Ch2Oh + hi => cho3Ch2I + H2OF
Ook kunnen alkenen HX -moleculen toevoegen aan hun dubbele bindingen, die secundaire alkylhalogenuros vormen.
Ch2= Ch-ch3 + HBR => BRCH2-Ch2-Ch3 + Ch3-Chbr-CH3
Het BRCH -product2-Ch2-Ch3 Het is de 1-bromopropano en cho3-Chbr-CH3 De 2-bromopropan. De tweede is het meerderheidsproduct omdat het degene is met de grootste stabiliteit, terwijl de eerste in mindere mate wordt geproduceerd omdat het onstabieler is. Dit komt omdat Cho3Chbrch3 Het is een secundair alkylhalogenide.
Zeer vergelijkbaar gebeurt wanneer wat wordt toegevoegd aan het alkeen een X -molecuul is2:
Ch2= Ch-ch3 + BR2 => BRCH2-Chbr-CH3
Een alkylhalogenide met twee broomatomen gekoppeld aan aangrenzende koolstofatomen wordt echter verkregen; buurt alkylhalogenide. Als aan de andere kant de twee bomo's die aan dezelfde koolstof zijn gekoppeld, zouden worden genomen, zou er een Geminaal alkylhalogenide zijn, zoals het volgende:
BR2CH-CH2-Ch3
Reacties
Nucleofiele vervanging
De reactiviteiten van de alkylhalogeniden zijn in de fragiliteit of weerstand van de C-X-link. Hoe zwaarder het halogeen, hoe zwakker de binding zal zijn, en daarom zal het gemakkelijker breken. In een chemische reactiekoppeling worden verbroken en nieuwe worden gevormd; C-X-links zijn verbroken om een C-G-link te vormen (G = nieuwe groep).
In meer geschikte termen fungeert X als een uitgaande groep en G als een inkomende groep in een reactie van Nucleofiele vervanging. Waarom gebeurt deze reactie? Omdat X, meer elektronegatief dan koolstof, "elektronische dichtheid" steelt "en een elektronentekort verlaat dat zich vertaalt als een positieve gedeeltelijke belasting:
Cδ+-Xδ-
Als een negatieve soort in de buurt is (: G-) of neutraal Met een paar beschikbare elektronen (: G), in staat om een stabielere C-G-link te vormen, zal X uiteindelijk worden vervangen door G. Het bovenstaande kan worden weergegeven met de volgende chemische vergelijking:
Rx +: g- => Rg + x-
Hoe zwakker de C-X of R-X-link, hoe groter de reactiviteit of de neiging om te worden vervangen door de Nucleofiel middel (of nucleofiel) G; dat wil zeggen liefhebbers van kernen of positieve ladingen.
Voorbeelden
Een reeks algemene vergelijkingen voor nucleofiele substituties die mogelijk alkylhalogeniden kunnen lijden, worden hieronder weergegeven:
Rx + oh- => ROH + X- (Alcohols)
+ Of'- => Ror' (Ethers, synthese van Williamson)
+ Je- => Ri (alkyl yoduros)
+ CN- => Rcn (nitrilos)
+ R'coo- => RCoor '(esters)
+ NH3 => Rnh2 (Amines)
+ P (C6H5))3 => Rp (c6H5))3+ X- (Fosfoniumzouten)
+ SH- => Rsh (tioles)
Kan u van dienst zijn: chemie -fasenUit deze voorbeelden kunnen de waardevolle alkylhalogeniden voor organische synthese worden vermoed. Een van de vele substituties die ontbrak, is die van de reactie van Friedel Crafts, gebruikt om aromatische ringen te "huren":
Rx + arh + alcl3 => Rra
In deze reactie wordt een H van de aromatische ring vervangen door een groep R -van de RX.
Eliminatie
Huurhalogeniden kunnen HX -moleculen afgeven door een eliminatiereactie; In het bijzonder een dehydrohalogenering:
R2CH-CXR2 + Oh- => R2C = Cr2 + HX
Er wordt gezegd dat een dehydrohalogenering optreedt omdat zowel een H als een X verloren gaan in dezelfde HX -molecuul.
Grignard -reagenssynthese
Huurhalogeniden kunnen reageren met bepaalde metalen die het reagens van Grignard vormen, gebruikt om R -groepen toe te voegen aan andere moleculen. De algemene vergelijking van de synthese is als volgt:
Rx + mg => rmgx
Voorbeelden
In de hele secties zijn al verschillende voorbeelden van alkylhalogenuros genoemd. Sommige anderen, eenvoudig, zijn:
-Ethylchloride, ch3Ch2Klet
-Isopropil fluoruro, (ch3))2Ch2F
-2-methyl-3-chloropentano, CH3-CH (Ch3) -Chcl -ch2Ch3
-Secbutilo Yoduro, CH3Ch2Ch2I-CH3
-3-broom-6-joodsheptano, ch3-Ch2-Chbr-CH2-Ch2-Ch2Je
-3.4-Dibromo-1-Penteno, CH3-CHBR-CHBR-CH = CH2
Toepassingen
Oplosmiddel
In eerdere secties werd de melding van de oplosmiddelcapaciteit van alkylhalogeniden gemaakt. Van deze eigenschap heeft de industrie van hen gebruik gemaakt als schoonmakers, hetzij voor textiel, elektronische componenten, of verwijdert u vernisvlekken.
Ze worden ook gebruikt als oplosmiddelen van schilderijen, of organische of vette monsters voor ontelbare soorten analytische tests.
Organische synthese
Huurhalogenuros zijn erg handig voor het "huren" van aromatische ringen, terwijl ze dienen als een startbron voor de synthese van vrijwel alle andere families van organische verbindingen. Synthetisch wordt RX beschouwd als een bron van groepen of R -ketens, die wil zijn om zeer aromatische verbindingen op te nemen.
Farmaceutische industrie
In het begin werd vermeld dat halogeenatomen interageren met biologische matrices, dus in onze organismen kunnen ze niet onopgemerkt blijven zonder een verandering, positief of negatief te genereren. Als een medicijn een positief effect op het lichaam uitoefent, kan dat met een halogeenatoom dat effect al dan niet toenemen.
Dus als X direct een koolstof met SP -hybridisatie is gekoppeld3, Er zal een alkylhalogenide zijn en geen gehalogeneerd derivaat. Sommige van dergelijke halogenuros worden hieronder weergegeven in de volgende reeks afbeeldingen:
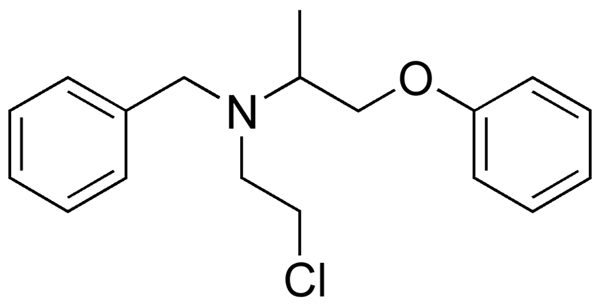 Fenoxibenzamine, een medicijn dat wordt gebruikt om bloeddruk te combineren bij patiënten met feochromocytoom. Bron: Utennt: Mark Pea [Public Domain].
Fenoxibenzamine, een medicijn dat wordt gebruikt om bloeddruk te combineren bij patiënten met feochromocytoom. Bron: Utennt: Mark Pea [Public Domain].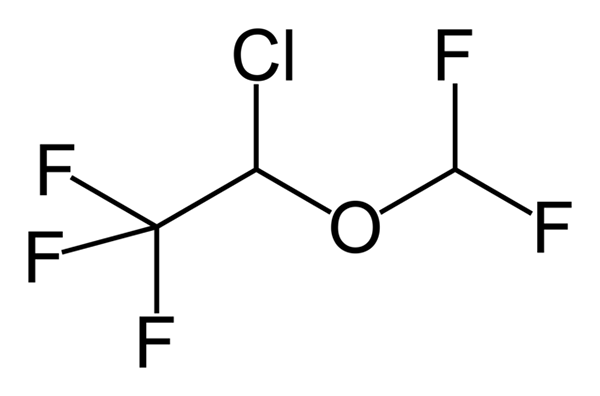 Isoflurano, een inhalatie -verdoving. Bron: Benjah-bmm27 [Public Domain].
Isoflurano, een inhalatie -verdoving. Bron: Benjah-bmm27 [Public Domain].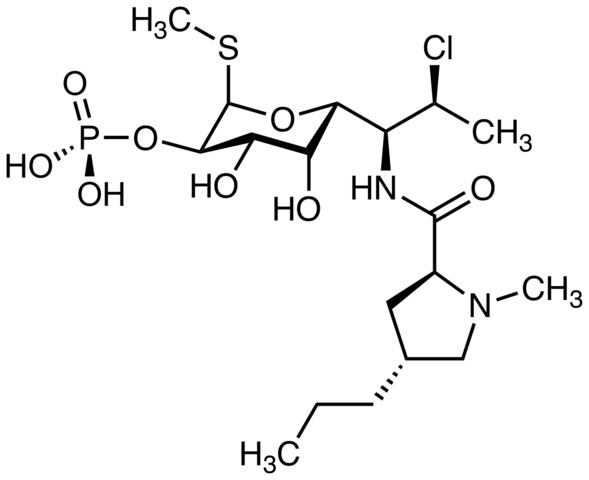 Clindamycin, een antibioticum. Bron: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)].
Clindamycin, een antibioticum. Bron: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Pimecrolimus, gebruikt om atopische dermatitis te behandelen. Kun je het chlooratoom vinden? Bron: Marinavladivok [CC0].
Pimecrolimus, gebruikt om atopische dermatitis te behandelen. Kun je het chlooratoom vinden? Bron: Marinavladivok [CC0]. Halomon, mogelijk antitumoraal middel en alkylhalogenide van de zeewier algen portieria hornemannii, een natuurlijke bron. Bron: Jü [Public Domain]
Halomon, mogelijk antitumoraal middel en alkylhalogenide van de zeewier algen portieria hornemannii, een natuurlijke bron. Bron: Jü [Public Domain]
Merk op dat er in deze vijf medicijnen ten minste één link van het ChO -type zijn2-X of CH-X; Dat wil zeggen, halogeen is gekoppeld aan een sp -carbon3.
Koelers
Het beroemde Freón-12-koelmiddel (chcif2), Net als andere fluoralcanos of hydrofluorocoolwaterstoffen, vervangen ze ammoniak en chloorofluorocarbons (CFC's) in deze functie omdat ze, zelfs niet -vluchtige of giftige stoffen, de ozonlaag vernietigden; Terwijl Freón-12, omdat het reactiever is, wordt vernietigd voordat ze dergelijke hoogten bereiken.
Referenties
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Clark Jim. (14 juli 2016). Gebruik van alkylhaliden. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Gál, B., Bucher, c., & Burns, n. Z. (2016). Chirale alkylhalogeniden: onder bestemde motieven in de geneeskunde. Marine Drugs, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkylhalogeniden. Opgehaald uit: Chemed.Chem.Purdue.Edu
- Patkar Prachi. (16 juli 2017). Alles over alkylhalogeniden: eigenschappen, gebruik en nog veel meer. Wetenschapstructuur. Hersteld van: sciencestruck.com
- R. schip. (2016). Alkylhalogeniden. Hersteld van: hyperfysica.Phy-Astr.GSU.Edu
- Leergids voor hoofdstuk 9 - alkylhalogeniden i. Hersteld van: cactus.Dixie.Edu
- Q.NAAR. Eduardo Vega Barrios. (S.F.)). Huur halogenuros: eigenschappen, gebruik en applicaties. [PDF. Hersteld van: cvonline.Uaeh.Edu.mx
- « Structuur van stikstofzuur (HNO2), eigenschappen, synthese
- Lithiumbromidestructuur, eigenschappen, gebruik, risico's »

