Anisol -structuur, eigenschappen, nomenclatuur, risico's en gebruik
- 2641
- 320
- Irving McClure I
Hij anisol of metoxibenzeen Het is een organische verbinding die bestaat uit een aromatische ether waarvan de chemische formule c is6H5Och3. Zijn fysieke conditie is die van een kleurloze vloeistof, die gele kleuren kan presenteren. Het wordt gemakkelijk herkend door zijn karakteristieke geur van anijs.
Het is dan een vluchtige verbinding en niet erg hoge cohesiekrachten; gebruikelijke kenmerken in lichte ethers, die worden opgeslagen in kleine verzegelde containers. In het bijzonder is anisol de eenvoudigste alkyl auril ether; dat wil zeggen, degenen met een aromatische component (AR) en een ander alkyl (r), ar-o-r.
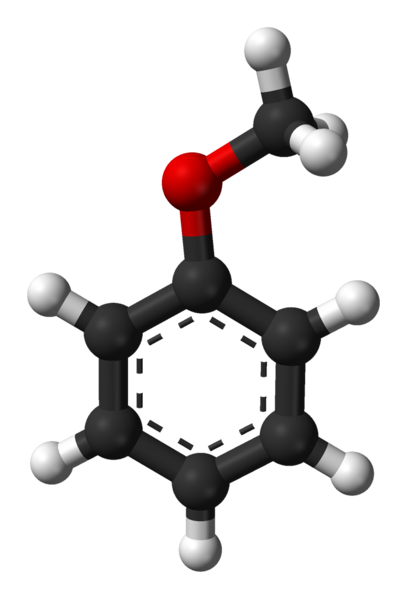
 Anisolmolecuul. Bron: Ben Mills via Wikipedia.
Anisolmolecuul. Bron: Ben Mills via Wikipedia. Groep C6H5- komt om AR aan te duiden, en -CH3 A r, dus C6H5-O-ch3. De aromatische ring en de aanwezigheid van -och3 Als een substituentgroep genaamd metoxi, geeft de anisol een nucleofiliciteit die superieur is aan die van benzeen en nitrobenzeen. Daarom dient het als een intermediair molecuul voor de synthese van verbindingen met farmacologische activiteit.
De karakteristieke geur van anijs is gebruikt om anisol toe te voegen aan cosmetische en hygiëneproducten die een aangename geur eisen.
[TOC]
Anisolstructuur
In het bovenste beeld wordt de moleculaire structuur van anisol weergegeven door middel van een bollen en stavenmodel. De aromatische ring wordt gewaardeerd, wiens koolstofatomen SP zijn2 en daarom is het plat, als een zeshoekig blad; En aan hem gekoppeld, is de metoxi -groep, wiens koolstof SP is3, en de hydrogenen zijn boven of onder het ringvlak.
Het belang van de -och groep3 In de structuur gaat het verder dan het breken met de platte geometrie van het molecuul: het geeft het polariteit, en bijgevolg verwerft het benzeenapolaire molecuul een permanent dipoolmoment.
Dipolair moment
Dit dipoolmoment is te wijten aan het zuurstofatoom, dat de elektronische dichtheden van zowel de aromatische als de methylring aantrekt. Dankzij dit kunnen de moleculen van Anisol half-dipolo-krachten interageren; Hoewel het geen mogelijkheid heeft om waterstofbruggen te vormen, omdat het een ether is (ROR heeft geen zuurstof gekoppeld).
Kan u van dienst zijn: natriumchloride (NaCl)Het hoge kookpunt (154 ° C), certificeert experimenteel de sterke intermoleculaire interacties die zijn vloeistof regelen. Evenzo zijn de dispersiekrachten in Londen aanwezig, afhankelijk van de moleculaire massa en π -π interacties tussen de ringen zelf.
Kristallen
Anisol's structuur staat hem echter niet toe.F = -37ºC). Dit kan ook te wijten zijn aan het feit dat wanneer intermoleculaire afstanden worden verminderd, elektrostatische afstotingen tussen aangrenzende aromatische ringen erg sterk zijn.
Daarom, en volgens kristallografische studies, kunnen anisolmoleculen in kristallen bij een temperatuur van -173ºC niet zodanig worden besteld dat hun ringen worden geconfronteerd; dat wil zeggen, zijn aromatische centra komen niet op elkaar aan, maar een groep -och3 Het is omhoog of onder een aangrenzende ring.
Eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof maar dat kan mild -gekleurde stro -tonen presenteren.
Geur
Het ruikt enigszins vergelijkbaar met anijzaadjes.
Smaak
Zoet; Het is echter matig giftig, dus deze test is gevaarlijk.
Moleculaire massa
108,140 g/mol.
Dikte
0,995 g/ml.
Dampdichtheid
3.72 (in luchtrelatie = 1).
Smeltpunt
-37ºC.
Kookpunt
154ºC.
ontstekingspunt
125ºC (open beker).
Zelf -richtingtemperatuur
475ºC.
Smurrie
0.778 CP bij 30ºC.
Oppervlaktespanning
34.15 DIN/CM A 30ºC.
Breking indica
1.5179 tot 20ºC.
Oplosbaarheid
Slecht oplosbaar in water (ongeveer 1 mg/ml). In andere oplosmiddelen, zoals aceton, ethers en alcoholen, is het toch erg oplosbaar.
Nucleofiliciteit
Anisol's aromatische ring is rijk aan elektronen. Dit komt omdat zuurstof, ondanks dat het een zeer elektronegatief atoom is, bijdraagt aan de elektronen van hun π wolk om ze door de ring te demociëren in talloze resonantiesstructuren. Bijgevolg reizen meer elektronen door het aromatische systeem en verhoogt daarom de nucleofiliciteit.
Het kan je van dienst zijn: kamferachtige alcohol: structuur, formule, eigenschappen en gebruikExperimenteel is de toename van nucleofiliciteit aangetoond door de reactiviteit ervan te vergelijken, in het licht van aromatische elektrofylische substituties, met die van benzeen. Het opmerkelijke effect van de -och groep wordt dus bewezen3 Op de chemische eigenschappen van de verbinding.
Er moet ook worden opgemerkt dat elektrofiele substituties optreden in aangrenzende posities (-orto) en tegenovergestelde (-for) voor de metoxi-groep; dat wil zeggen, dit is ortho-voor regisseur.
Reactiviteit
Met de aromatische ring -nucleofiliciteit van Anisol kunt u al een glimp opvangen hoe de reactiviteit ervan is. De substituties kunnen optreden in de ring (begunstigd door zijn nucleofiliciteit), of in dezelfde metaxi -groep; In het laatste is de O-C-link verbroken3 Om de -CH te vervangen3 door een andere alquilische groep: o-alquilación.
Daarom kan anisol in een alkyleringsproces een groep R (fragment van een ander molecuul) accepteren dat een H van zijn ring (C-leven) vervangt, of de CH vervangen3 Van uw metoxi -groep. De volgende afbeelding illustreert wat er net is gezegd:
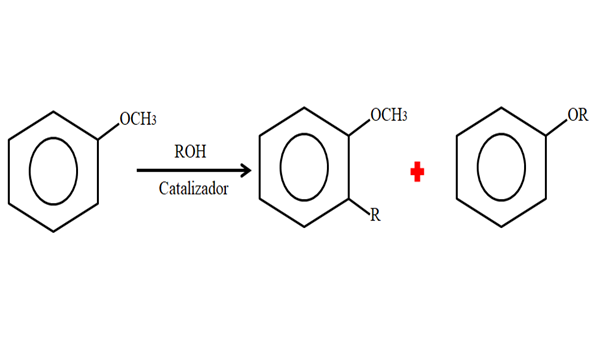 Anisol -alkylering. Bron: Gabriel Bolívar.
Anisol -alkylering. Bron: Gabriel Bolívar. In de afbeelding bevindt de R -groep zich in positie -orto, maar het kan ook in de positie zijn -tegenover -och3. Wanneer O -Alquilación plaatsvindt, wordt een nieuwe ether met een andere groep -of verkregen.
Nomenclatuur
De naam 'anisol' is de bekendste en geaccepteerde, waarschijnlijk afgeleid van zijn geur vergelijkbaar met anijs. De naam 'metoxibenzeen' is echter vrij specifiek, omdat deze eenmaal de structuur en identiteit van deze aromatische ether vaststelt; Dit is de naam die wordt beheerst door de systematische nomenclatuur.
Een andere minder gebruikte naam, maar even geldig, is de 'fenylmethylether', die wordt beheerst door de traditionele nomenclatuur. Dit is misschien wel de meest specifieke naam van allemaal, omdat het direct aangeeft welke de twee structurele delen van de ether zijn: Phoenyl-oethyl, C6H5-O-ch3.
Risico's
Medische studies hebben bij lage doses nog niet de mogelijke sterfelijke effecten van anisol op het lichaam kunnen aantonen. Zoals bijna alle chemische stoffen, produceert het echter irritaties wanneer te tijd wordt blootgesteld en in matige concentraties aan de huid, keel, longen en ogen.
Kan u van dienst zijn: Amagat Law: uitleg, voorbeelden, oefeningenOok is een deel ervan vanwege de nucleofiliciteit van zijn ring gemetaboliseerd en is daarom biologisch afbreekbaar. Als gevolg van deze eigenschap toonde simulaties zelfs aan dat het zich niet concentreert op waterige ecosystemen, omdat de organismen het voor het eerst afbreken; En daarom kunnen rivieren, meren of zeeën anisol verzamelen.
In de bodem, gezien zijn volatiliteit, verdampt het snel en wordt het door luchtstromen gesleept; Dus, dus ook groentemassa's of plantages beïnvloeden aanzienlijk.
Aan de andere kant reageert het atmosferiek met vrije radicalen en vertegenwoordigt het daarom geen risico op luchtvervuiling die we inademen.
Toepassingen
Organische synthese
Van anisol kunnen andere derivaten worden verkregen door aromatische elektrofiele substitutie. Dit maakt het mogelijk om te worden gebruikt als intermediair voor de synthese van medicijnen, pesticiden en oplosmiddelen, die hun kenmerken willen toevoegen. Synthetische routes kunnen meestal bestaan uit een.
Geuren
Naast het gebruik ervan voor organische synthese, kan het rechtstreeks worden gebruikt als een additief voor crèmes, zalven en parfums, met anti -geuren in dergelijke producten.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. NAAR. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Nationaal centrum voor biotechnologie -informatie. (2019). Anisole. PubChem -database, CID = 7519. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Anisole. Opgehaald uit: in.Wikipedia.borg
- Pereira, Cynthia C. M., De la cruz, Marcus h. C., & Lachter, Elizabeth R. (2010). Vloeibare faselatie van anisol en fenol gekatalyseerd door niobiumfosfaat. Journal of the Brazilian Chemical Society, 21 (2), 367-370. Dx.doen.org/10.1590/s0103-50532010000200025
- Seidel R. W. en Goddard R. (2015). Anisole bij 100 K: de eerste bepaling van de kristalstructuur. Crystallogr C Struct Chem Act. Aug; 71 (PT 8): 664-6. Doi: 10.1107/S2053229615012553
- Chemische formulering. (2018). Metoxibenzeen. Hersteld van: Quimica -formulering.com

