Acrilonitrile structuur, eigenschappen, productie, gebruik

- 635
- 25
- Aaron Okuneva
Hij acilonitril Het is een organische verbinding waarvan de gecondenseerde formule cho is2Chcn. Het is een van de eenvoudigste nitrillen die bestaan. Chemie en structureel is het niets meer dan het product van de Unie tussen een vinylgroep, Cho2= CH- en een nitril, cyanidegroep, C≡N. Het is een substantie met grote industriële impact op de wereld van kunststoffen.
Fysiek is het een kleurloze vloeistof, met een bepaalde geur van ui, en die in onzuivere toestand presenteert geelachtige tonen. Het is zeer ontvlambaar, giftig en mogelijk carcinogeen, dus het is geclassificeerd als een extreem gevaarlijke stof. Ironisch genoeg zijn ze geproduceerde kunststoffen en speelgoed van het dagelijkse leven, zoals tupperware en LEGO -blokken.
 Acrilonitril -polymeren zijn aanwezig in het Tupperware -plastic. Bron: Stebulus via Wikipedia.
Acrilonitril -polymeren zijn aanwezig in het Tupperware -plastic. Bron: Stebulus via Wikipedia. Op industriële schalen, acrilonitril. Bijna alle geproduceerde hoeveelheid is bedoeld voor de productie van kunststoffen, gebaseerd op homopolymeren, zoals polyacrylonitril, of in copolymeren, zoals acrilonitril-butadieen-styreen.
[TOC]
Acilonitrilstructuur
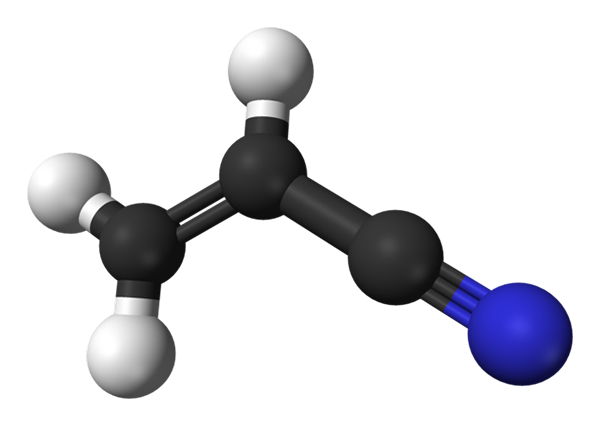 Moleculaire structuur van acrilonitril. Bron: Benjah-BMM27 / Public Domain
Moleculaire structuur van acrilonitril. Bron: Benjah-BMM27 / Public Domain In het bovenste beeld hebben we het acrilonitrilmolecuul weergegeven met een model van bollen en bars. De zwarte bollen komen overeen met koolstofatomen, terwijl respectievelijk wit en blauw tot waterstof- en stikstofatomen. Links, ch2= CH- komt overeen met de vinylgroep en de rechterkant, met de cyano-groep, C≡N.
Het hele molecuul is plat, omdat de koolstofatomen van de vinylgroep SP -hybridisatie hebben2. Ondertussen heeft de Ciano Group -koolstof SP -hybridisatie, naast het stikstofatoom in een lijn die op hetzelfde vlak rust als de rest van de molecuul.
De CN -groep draagt polariteit bij aan het molecuul, dus het molecuul cho2CHCN stelt een permanente dipool vast waar de hoogste elektronische dichtheid is gericht op het stikstofatoom. Daarom dipool-dipol.
Kan u van dienst zijn: wat is chemische periodiciteit?De moleculen ch2CHCN zijn plat en kunnen verwachten dat ze in hun kristallen (gestold bij -84 ºC) op elkaar beschikbaar zijn, zoals lakens of vellen papier, zodat hun dipolen niet afstoten.
Eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof maar met geelachtige tonen wanneer het enkele onzuiverheden presenteert. Indien zo, raden ze aan om het te destilleren voorafgaand aan het gebruik ervan. Het is vluchtig en heeft ook een intense geur vergelijkbaar met de ui.
Molaire massa
53.064 g/mol
Smeltpunt
-84 ºC
Kookpunt
77 ºC
Flitspunt
-5 ºC (gesloten beker)
0 ºC (open beker)
Zelf -richtingtemperatuur
481 ºC
Dikte
0,81 g/cm3
Dampdichtheid
1.83 in luchtrelatie.
Dampdruk
109 mmHg bij 25 ºC
Oplosbaarheid
In het water heeft het een oplosbaarheid van 74 g/l tot 25 ºC. Acrilonitril is ook aanzienlijk oplosbaar in aceton, olie, ethanol, ethylacetaat en benzeen ethanile.
Ontleding
Wanneer thermisch toxische waterstofcyanide, koolstofoxiden en stikstofoxiden vrijgeeft.
Productie
SOHIO -proces
Acryonitril kan optreden op massieve schalen door talloze reacties en chemische processen. Van al ze is het SOHIO -proces het meest gebruikt, dat bestaat uit de katalytische amaxidatie van het propyleen. In een gefluïdiseerde bedreactor wordt het propyleen gemengd met lucht en ammoniak bij een temperatuur rond 400 en 510 ºC, waar ze reageren op vaste katalysatoren.
De reactanten komen eenmaal in de reactor en plaatsvinden de volgende reactie:
2CH3−ch = ch2 + 2 NH3 + 3 o2 → 2 ch2= CH-C≡N + 6 H2OF
Merk op dat zuurstof wordt gereduceerd tot water, terwijl propyleen acilonitril oxideert. Vandaar de naam 'amoxidatie', omdat het een oxidatie is die de deelname van ammoniak inhoudt.
Kan u van dienst zijn: koken: concept, soorten en voorbeeldenAlternatieve processen
Naast het SOHIO -proces kunnen andere reacties worden vermeld die het verkrijgen van acilonitril mogelijk maken. Het is duidelijk dat ze niet allemaal schaalbaar zijn, of althans op een voldoende winstgevende manier, noch producten genereren met hoge prestaties of zuiverheid.
Acrylonitril wordt gesynthetiseerd, opnieuw uit propyleen, maar laat het reageren met stikstofoxide op PBO -katalysatoren2-Zro2 Airgel -vormig. De reactie is als volgt:
4 ch3−ch = ch2 + 6 Nee → 4 Cho2= CH-C≡N + 6 H2Of + n2
Een reactie die geen propyleen inhoudt, is degene die begint met ethyleenoxide, dat reageert met waterstofcyanide om te transformeren in ethyleencyanohydrine; En later wordt het uitgedroogd bij een temperatuur van 200 ºC in de acrilonitril:
ETO + HCN → CH2Ohch2CN
Ch2Ohch2CN + Q (200 ºC) → CH2= CH-C≡N +H2OF
Een andere veel directere reactie is de toevoeging van waterstofcyanide op acetyleen:
HC≡CH + HCN → CH2= CH-C≡N
Er worden echter veel secundaire producten gevormd, dus de kwaliteit van acilonitril is lager in vergelijking met die van het SOHIO -proces.
Naast de bovengenoemde stoffen, lactonitril, propionitril.
Toepassingen
 Lego's worden voornamelijk vervaardigd met ABS -plastic, een copolymeer waarbij acilonitril deel is. Bron: Pxhere.
Lego's worden voornamelijk vervaardigd met ABS -plastic, een copolymeer waarbij acilonitril deel is. Bron: Pxhere. Acrilonitrile is een onmisbare stof voor de kunststofindustrie. Verschillende van zijn afgeleide kunststoffen zijn zeer bekend. Dat is het geval van de acrilonitrilo-butadieen-styreen copolymeren (ABS), waarmee de stukken van de leken worden vervaardigd. We hebben ook acrylvezels, uitgewerkt met het polyacrylonitril homopolymer (PAN).
Kan u van dienst zijn: verzepingOnder andere kunststoffen die acrilonitril bevatten als een monomeer, of die ervan afhankelijk zijn voor de productie ervan, hebben we: acrylene stretch (SAN), butadieen acrylonitril (NBR), acrilonitril stretch acrylaat (ASA), polyacrylamide en synthetische rubbers en nitrilebruden en nitriles en nitriles en nitriles en nitrilebruden.
Praktisch kan elk natuurlijk polymeer, zoals katoen, worden gemodificeerd door zijn moleculaire structuren op te nemen in acilonitril. Aldus worden nitrilderivaten verkregen, wat de chemie van de zeer brede acrylonitril maakt.
Een van de toepassingen buiten de wereld van kunststoffen is als pesticiden gemengd met koolstoftetrachloride. Vanwege de vreselijke impact op het mariene ecosysteem hebben dergelijke pesticiden echter zichzelf verboden of zijn ze aan sterke beperkingen onderworpen.
Risico's
Acrilonitril is een gevaarlijke stof, dus het moet met extreme zorg worden gemanipuleerd. Elke ongepaste of overmatig langdurige blootstelling aan deze verbinding kan dodelijk zijn, hetzij door inademing, inname of fysiek contact.
Het moet zo ver mogelijk worden gehandhaafd van elke warmtebron, omdat het een vluchtige en zeer ontvlambare vloeistof is. Noch moet hij contact hebben met water, omdat hij gewelddadig met haar reageert.
Daarnaast is het een mogelijk carcinogene stof, die is geassocieerd met lever- en longkankers. Degenen die aan deze stof zijn blootgesteld, hebben een toename van de niveaus van tiocyanaat uitgescheiden in de urine en bloedcyanide.
Referenties
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. 5e editie. Redactionele addison-wesley inter-Amerikaan.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e editie.)). Wiley Plus.
- Wikipedia. (2020). Acrylonitril. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Acrylonitril. PubChem -database., CID = 7855. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Elsevier B.V. (2020). Acrylonitril. Wetenschappelijk. Opgehaald uit: Scientedirect.com
- Korry Barnes. (2020). Wat is acrylonitril? - Gebruik en eigenschappen. Studie. Hersteld van: studie.com
- Pajonk, g.M., Manzalji, t. (1993). Synthese van acrylonitril uit propyleen- en stikstofoxide -mengsels op PBO2-Zro2 Airgelkatalysatoren. Catal Lett eenentwintig, 361-369. doen.org/10.1007/BF00769488
- « Dynamische programmeerkenmerken, bijvoorbeeld voor-, nadelen
- Wat is een isotherme proces? (Voorbeelden, oefeningen) »

