Wat is een isotherme proces? (Voorbeelden, oefeningen)

- 3548
- 836
- Cecil Graham
Hij isotherme proces of isotherm is een omkeerbaar thermodynamisch proces waarbij de temperatuur constant blijft. In een gas zijn er situaties waarin een verandering in het systeem geen temperatuurvariaties oplevert, maar in fysieke kenmerken.
Deze veranderingen zijn faseveranderingen, wanneer de stof verandert van vaste stof in vloeistof, van gasvloeistof of vice versa. In dergelijke gevallen passen middelenmoleculen hun positie aan, het toevoegen of extraheren van thermische energie.
 Figuur 1. De carambans die smelten zijn een voorbeeld van het isotherme proces. Bron: Pixabay.
Figuur 1. De carambans die smelten zijn een voorbeeld van het isotherme proces. Bron: Pixabay. De thermische energie die nodig is om een faseverandering in een stof te laten plaatsvinden, wordt latente warmte of transformatiewarmte genoemd.
Een manier om een isotherme proces te krijgen, is door contact op te nemen met de stof die het systeem zal zijn dat wordt bestudeerd met een externe thermische afzetting, een ander groot calorisch capaciteitssysteem. Op deze manier treedt een dergelijke langzame warmte -uitwisseling op, dat de temperatuur constant blijft.
Dit soort processen worden vaak in de natuur gegeven. Bij mensen bijvoorbeeld wanneer lichaamstemperatuur stijgt of daalt, voelen we ons ziek, omdat in ons lichaam talloze chemische reacties die het leven behouden bij constante temperatuur worden gegeven. Dit is geldig voor heet bloed in het algemeen.
Andere voorbeelden zijn die van ijs dat smelt van hitte wanneer de lente en ijsblokjes aankomen.
[TOC]
Voorbeelden van isotherme processen
-Het metabolisme van het heet van de bloeide dieren wordt uitgevoerd bij constante temperatuur.
 Figuur 2. Hot -geblokkeerde dieren hebben mechanismen om de temperatuur constant te houden. Bron: Wikimedia Commons.
Figuur 2. Hot -geblokkeerde dieren hebben mechanismen om de temperatuur constant te houden. Bron: Wikimedia Commons. -Wanneer het water kookt, treedt een faseverandering op, van gasvloeistof en de temperatuur blijft constant bij ongeveer 100 º C, omdat andere factoren de waarde kunnen beïnvloeden.
-Het ijs dat smelt is een ander frequent isothermproces, evenals het plaatsen van water in de vriezer om ijsblokjes te maken.
Kan u van dienst zijn: Geometrische optiek: welke studies, wetten, toepassingen, oefeningen-Automotoren, koelkasten, evenals vele andere soorten machines, werken correct in een bepaald temperatuurbereik. Om de juiste temperatuur te handhaven, worden apparaten genoemd Thermostaten. In zijn ontwerp worden verschillende operationele principes gebruikt.
Carnot's cyclus
Een Carnot -motor is een ideale machine waaruit werk wordt verkregen dankzij volledig omkeerbare processen. Het is een ideale machine omdat het geen processen beschouwt die energie afwijken, als een viscositeit van de stof die het werk doet, noch wrijving.
De carnotcyclus bestaat uit vier fasen, waarvan er twee precies isotherm en de andere twee adiabatisch zijn. De isotherme fasen zijn compressie en uitbreiding van een gas dat verantwoordelijk is voor het produceren van het nuttige werk.
Een auto -engine werkt met vergelijkbare principes. De beweging van een zuiger in de cilinder wordt overgedragen op andere delen van de auto en produceert beweging. Het heeft niet het gedrag van een ideaal systeem zoals de Carnot -motor, maar de thermodynamische principes zijn gebruikelijk.
Berekening van het werk dat is uitgevoerd in een isotherme proces
Om het werk te berekenen dat door een systeem wordt uitgevoerd wanneer de temperatuur constant is, moet de eerste wet van de thermodynamica worden gebruikt, die stelt:
Δu = q - w
Dit is een andere manier om het behoud van energie in het systeem uit te drukken, gepresenteerd door AU of verandering in energie, Q Terwijl de hitte werd geleverd en ten slotte W, dat is het werk dat wordt gedaan door genoemde systeem.
Stel dat het systeem in kwestie een ideaal gas is in de cilinder van een zuiger van een mobiel gebied NAAR, Wat werkt als het volume is V verandering van V1 naar V2.
 figuur 3. In een isotherme proces breidt het gas in de zuiger uit zonder de temperatuur te veranderen. Bron: YouTube.
figuur 3. In een isotherme proces breidt het gas in de zuiger uit zonder de temperatuur te veranderen. Bron: YouTube. De ideale gasstatusvergelijking is PV = NRT, die het volume relateert aan de druk P en de temperatuur T. De waarden van N en R zijn constant: n is het aantal mol van het gas en r de gasconstante. In het geval van een isotherme proces het product PV het is constant.
Kan u van dienst zijn: Antoine -constanten: formules, vergelijkingen, voorbeeldenWelnu, het werk wordt berekend door een klein differentieel werk te integreren, waarin een kracht F produceert een kleine DX -verplaatsing:
Dw = fdx = padx
Als ADX is precies de variatie van het volume Dv, Dus:
DW = PDV
Om totaal werk te verkrijgen in een isotherme proces, is de uitdrukking van DW geïntegreerd:
De druk P en het volume V Het zijn grafieken in een diagram P-v Zoals die in de figuur getoond en het werk dat is gedaan, is gelijk aan het gebied onder de curve:
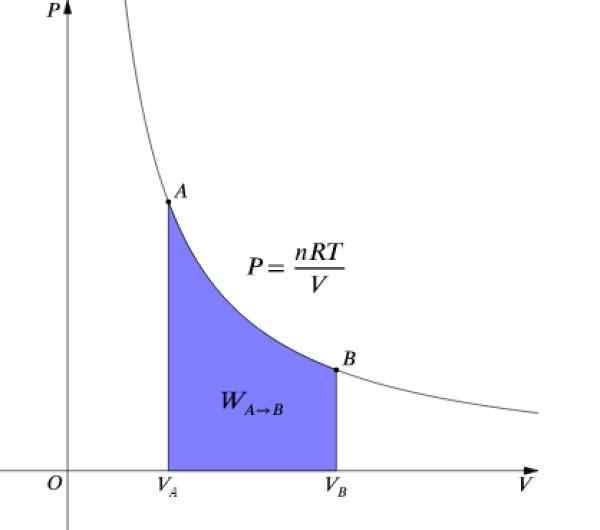 Figuur 4. P-V-diagram van een isotherme proces. Bron: Wikimedia Commons.
Figuur 4. P-V-diagram van een isotherme proces. Bron: Wikimedia Commons. Als Δu = 0 Omdat de temperatuur constant blijft, moet het in een isotherme proces:
Q = W
- Oefening 1
Een cilinder voorzien van een mobiele zuiger bevat een ideaal gas bij 127 ºC. Als de zuiger beweegt totdat het initiële volume 10 keer wordt verlaagd, waarbij de temperatuur constant wordt gehouden, zoek dan de hoeveelheid mol in de cilinder, als het werk dat op het gas is gedaan 38 is.180 J.
Feit: R = 8.3 J/mol. K
Oplossing
De verklaring bevestigt dat de temperatuur constant blijft, dan zijn we in aanwezigheid van een isotherme proces. Voor het werk dat aan het gas is gedaan, hebt u de eerder afgetrokken vergelijking:

127 º C = 127 + 273 K = 400 K
N duidelijk, het aantal mol:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 J/mol.K X 400 K X LN (V2/10V2) = 5 mol
Een negatief teken was vóór het werk. De attente lezer zal in de voorgaande sectie hebben opgemerkt dat W werd gedefinieerd als "het werk van het systeem" en een teken heeft +. Dus het "werk gedaan aan het systeem" heeft een negatief teken.
Het kan u van dienst zijn: tweede evenwichtstoestand: uitleg, voorbeelden, oefeningen- Oefening 2
Je hebt lucht in een cilinder voorzien van een plunjer. Aanvankelijk zijn er 0.4 m3 druk bij 100 kPa en 80 º C temperatuur. De lucht wordt gecomprimeerd op 0.1 m3 Zorg ervoor dat de temperatuur in de cilinder tijdens het proces constant blijft.
Bepaal hoeveel werk er tijdens dit proces wordt gedaan.
Oplossing
We gebruiken de vergelijking voor het eerder afgetrokken werk, maar het aantal mol is onbekend, dat kan worden berekend met de vergelijking van de ideale gassen:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = p1V1 /Rt = 100000 Pa x 0.4 m3 /8.3 J/mol. K x 353 K = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 J/mol. K X 353 K X LN (0.1/0.4) = -55.442.26 J
Nogmaals, het negatieve teken geeft aan dat het werk aan het systeem is verricht, wat altijd gebeurt wanneer gas wordt gecomprimeerd.
Referenties
- Bauer, W. 2011. Fysica voor engineering en wetenschappen. Deel 1. MC Graw Hill.
- Cengel, en. 2012. Thermodynamica. 7ma Editie. McGraw Hill.
- Figueroa, D. (2005). Serie: Physics for Science and Engineering. Deel 4. Vloeistoffen en thermodynamica. Uitgegeven door Douglas Figueroa (USB).
- Ridder, r. 2017. Fysica voor wetenschappers en engineering: een strategiebenadering.
- Serway, r., Vulle, c. 2011. Fundamentals of Physics. 9NA Cengage leren.
- Wikipedia. Isotherme proces. Opgehaald uit: in.Wikipedia.borg.
- « Acrilonitrile structuur, eigenschappen, productie, gebruik
- Opeenvolgende zinnen wat zijn en 75 voorbeelden »


