50 voorbeelden van zuren en basen

- 921
- 245
- Aaron Okuneva
Er zijn honderden Voorbeelden van zuren en basen Dat is te vinden in alle takken van chemie, maar dat ze als geheel worden gescheiden in twee grote families: anorganisch en organisch. Anorganische zuren worden meestal bekend als minerale zuren, gekenmerkt door bijzonder sterk te zijn in vergelijking met organisch.
Zuren en basen worden opgevat als stoffen die respectievelijk agressieve smaken of Saponáceos hebben. Beide zijn corrosief, hoewel het woord 'bijtend' meestal wordt gebruikt voor sterke basen. Samenvattende accounts: ze verbranden en rennen de huid als ze hem aanraken. De kenmerken ervan in oplosmiddelmedia hebben in de geschiedenis een reeks definities gepland.
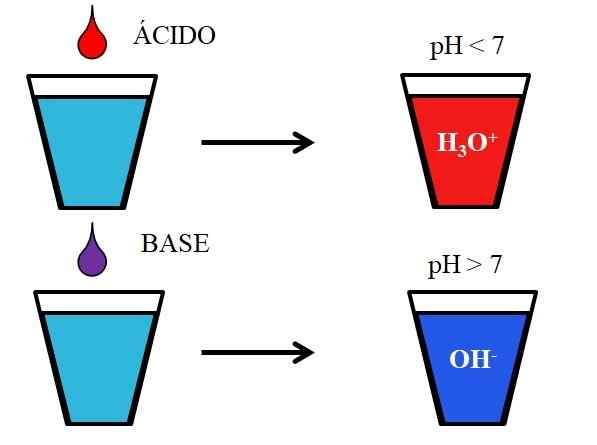 Gedrag van zuren en basen wanneer opgelost in water. Bron: Gabriel Bolívar.
Gedrag van zuren en basen wanneer opgelost in water. Bron: Gabriel Bolívar. Het onderste beeld toont het generieke gedrag van zuren en basen wanneer ze worden toegevoegd of opgelost in een glas met water. Zuren produceren oplossingen met pH -waarden onder de 7 vanwege hydroniosionen, h3OF+; Terwijl de basen oplossingen produceren met pH boven 7 vanwege hydroxylionen (of oxydril), oh-.
Als we zoutzuur, HCl (rode druppel), aan het glas toevoegen, zullen er H -ionen zijn3OF+ en Cl- gehydrateerd. Aan de andere kant, als we het experiment herhalen met natriumhydroxide, NaOH (paarse druppel), zullen we oh ionen hebben- en NA+.
[TOC]
Definities

De kenmerken, in toenemende mate bestudeerd en begrepen, van zuren en basen bepalen meer dan één definitie voor deze chemische verbindingen. Onder deze definities hebben we die van Arrhenius, die van Bronsted-Lowry, en ten slotte die van Lewis. Voordat u de voorbeelden citeert, is het noodzakelijk om dit duidelijk te hebben.
Arrhenius
Zuren en basen, volgens Arrhenius, zijn die die opgelost zijn in water produceren H -ionen3OF+ of oh-, respectievelijk. Dat wil zeggen, de afbeelding vertegenwoordigt deze definitie al. Op zichzelf veracht het echter enkele te zwakke zuren of basen om dergelijke ionen te produceren. Dit is waar de definitie van Bronsted-Lowry binnenkomt.
Kan u van dienst zijn: zuren: kenmerken en voorbeeldenBronsted-Lowry
Bronsted-lowryzuren zijn die die ionen honden hen+, En de bases zijn die die deze accepteren+. Als een zuur heel gemakkelijk doneert+, Het betekent dat het een sterk zuur is. Hetzelfde geldt voor de bases, maar accepteren h+.
We hebben dus sterke of zwakke zuren en basen en hun krachten worden gemeten in verschillende oplosmiddelen; vooral in het water, waarvan de bekende pH -eenheden worden vastgesteld (van 0 tot 14).
Daarom zal een sterk zuur zijn h volledig doneren+ op het water in een reactie van het type:
HA + H2O => a- + H3OF+
Waarheen- Het is de geconjugeerde basis van HA. Vanaf hier komt daarom de h3OF+ aanwezig in het glas met zure oplossing.
Ondertussen zal een zwakke B -base het water onbeschermd om zijn respectieve h te winnen+:
B + H2Of HB + OH-
Waar HB het geconjugeerde zuur van B is. Dit is het geval van ammoniak, NH3:
NH3 + H2Of NH4+ + Oh-
Een zeer sterke basis kan OH -ionen rechtstreeks doneren- Het is niet nodig om met water te reageren; Zoals bij de NaOH.
Lewis
Ten slotte zijn Lewis -zuren degenen die elektronen winnen of accepteren, en de bases van Lewis zijn die die elektronen doneren of verliezen.
Bijvoorbeeld de Bronsted-Lowry NH-basis3 Het is ook een Lewis -basis, omdat het stikstofatoom een h accepteert+ Door dit hun paar gratis elektronen te doneren (h3N: H+)). Dat is de reden waarom de drie definities het niet met elkaar eens zijn, maar ze verweven zijn en helpen ze de zuurgraad en basiciteit te bestuderen in een breder spectrum van chemische verbindingen.
Kan u van dienst zijn: Nikkel: Geschiedenis, eigenschappen, structuur, gebruik, risico'sVoorbeelden van zuren
Na de definities te hebben verduidelijkt, wordt hieronder een reeks zuren genoemd met hun respectieve formules en namen:
-HF: fluorhydriczuur
-HBR: Bromhydric Acid
-Hallo: yodhydriczuur
-H2S: Sulfhydrinezuur
-H2SE: SELEENHYDRIC ZUUR
-H2TE: Telurhydrinezuur
Dit zijn binaire zuren, ook wel hydrasids genoemd, die behoren tot het bovengenoemde zoutzuur, HCl.
-Hno3: salpeterzuur
-Hno2: Stikstofzuur
-HNO: Hyponitreus zuur
-H2CO3: Koolzuur
-H2CO2: carbonosozuur, dat eigenlijk meer bekend is tegen de naam mierenzuur, HCOOH, het eenvoudigste organische zuur van allemaal
-H3Po4: fosforzuur
-H3Po3 of h2[HPO3]: fosforzuur, met een H-P-binding
-H3Po2 of h [h2Po2]: Hypofosferisch zuur, met twee H-P-bindingen
-H2SW4: zwavelzuur
-H2SW3: Zwavelzuur
-H2S2OF7: Disulfuric acid
-Hio4: periódiczuur
-Hio3: Yodiumzuur
-Hio2: jodosezuur
-Hio: Hypoyodoso Acid
-H2Cro4: chroomzuur
-Hmno4: Manganzuur
-Ch3COOH: azijnzuur (azijn)
-Ch3SW3H: Metanosulfonzuur
Al deze zuren, behalve de formiek en de laatste twee, staan bekend als oxácidos of ternaire zuren.
Anderen:
-Alcl3: aluminiumchloride
-Fecl3: ijzerchloride
-BF3: Boro Trifluoruro
-Metalen kationen opgelost in water
-Carbocaties
-H (CHBelfKletelf): Superzuur Carborano
- FSO3H: Fluorosulfonzuur
- HSBF6: Fluoroantimonzuur
- FSO3H · SBF5: Magiezuur
De laatste vier voorbeelden vormen de angstaanjagende superzuren; Verbindingen die in staat zijn om bijna elk materiaal uiteen te vallen met het nauwelijks aanraken. De alcl3 Het is een voorbeeld van Lewis -zuur, omdat het aluminium metaalcentrum in staat is om elektronen te accepteren vanwege zijn elektronische tekortkoming (het voltooit zijn Valencia Octet niet).
Kan u van dienst zijn: Mercury Hydroxide: structuur, eigenschappen, gebruik, risico'sVoorbeelden van bases
Onder de anorganische bases hebben we metaalhydroxiden, zoals natriumhydroxide, en sommige moleculaire hydurns, zoals al geciteerde ammoniak. Hier zijn andere voorbeelden van bases:
-KOH: Kaliumhydroxide
-LIOH: Lithiumhydroxide
-RBOH: Rubidio Hydroxide
-CSOH: Cesiumhydroxide
-FROH: Francio Hydroxide
-Be (oh)2: berylhydroxide
-Mg (oh)2: magnesium hydroxide
-CA (oh)2: calcium hydroxide
-SR (OH)2: Strontiumhydroxide
-Ba (oh)2: Bariumhydroxide
-Ra (oh)2: radiohydroxide
-Geloof (oh)2: Ferrous Hydroxide
-Geloof (oh)3: ferrische hydroxide
-AL (oh)3: aluminiumhydroxide
-PB (OH)4: Plúmbic hydroxide
-Zn (OH)2: zinkhydroxide
-CD (OH)2: cadmiumhydroxide
-Cu (OH)2: Cupric hydroxide
-Ti (oh)4: Titanic Hydroxide
-PH3: fosfine
-As3: Arsina
-Nanh2: Natrium amiduro
- C5H5N: Pyridine
-(Ch3) N: trimethylamine
- C6H5NH2: Fenylamine of aniline
-NAH: Natriumhydride
-KH: Kaliumhydride
-Carbanions
-Li3N: Lithium Nitride
-Alcoxiden
-[(Ch3))2CH]2NLI: diisopropilamide van lithium
-Dietinilbenzeenanion: C6H4C42- (de sterkste basis die tot nu toe bekend is)
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Naomi Hennah. (10 oktober 2018). Hoe zuren, bases en zouten te onderwijzen. Hersteld van: edu.RSC.borg
- Helmestine, Anne Marie, pH.D. (31 augustus 2019). Formules van gemeenschappelijke zuren en basen. Hersteld van: Thoughtco.com
- David Wood. (2019). Vergelijk gewone zuren en basen. Studie. Hersteld van: studie.com
- Ross Pomeroy. (23 augustus 2013). De sterkste zuren ter wereld: zoals vuur en ijs. Hersteld van: realClearScience.com
- Wikipedia. (2019). Diethynylbenzeen Dianion. Opgehaald uit: in.Wikipedia.borg
- « Diameter symbolen en formules, hoe het uit te schakelen, omtrek
- Ecofysiologie Welke studies en toepassingen bij dieren en groenten »

