Kalium yodato (kio3)
- 2590
- 740
- Aaron Okuneva
Wat is kaliumjodaat?
Kalium of kalium Yodato Yodato is een anorganische jodiumverbinding, met name een zout, waarvan de chemische formule kio is3. Het jodium of jodium, element van de halogeengroep (f, cl, br, i, as), heeft in dit zout een oxidatienummer van +5; Daarom is het een sterk oxidatiemiddel. De kio3 Het dissocieert in waterig medium om de kionen te maken+ en IO3-.
Het wordt gesynthetiseerd door kaliumhydroxide te reageren met yodiumzuur: HIO3(aq) + koh (s) => kio3(aq) + h2Of (l). Het kan ook worden gesynthetiseerd door te reageren op moleculair jodium met kaliumhydroxide: 3i2(s)+6koh (s) => kio3(aq) + 5ki (aq) + 3H2Of (l).
Kalium Yodato -eigenschappen
 Kalium yodato uiterlijk
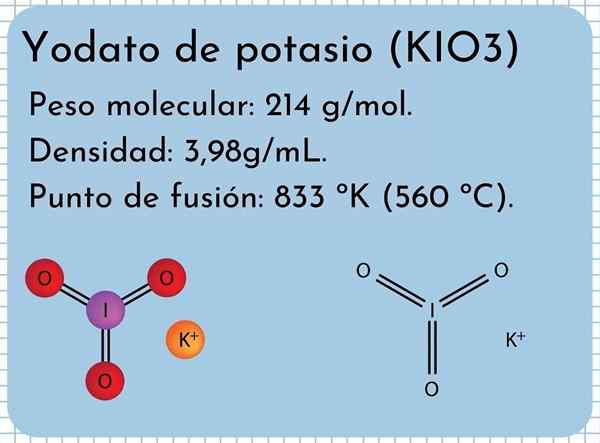
Kalium yodato uiterlijk Het is een reukloze witte vaste stof, fijne kristallen en met een monokliene kristallijne structuur. Het heeft een dichtheid van 3,98 g/ml, een molecuulgewicht van 214 g/mol en presenteert absorptiebanden in het infraroodspectrum (IR).
Het heeft een smeltpunt: 833 ºK (560 ºC), bestaande uit sterke ionische interacties tussen kionen+ en IO3-. Bij hogere temperaturen, een thermische ontledingsreactie, die moleculaire zuurstof en kaliumjodide vrijgeven:
2kio3(s) => 2ki (s) + 3o2(G)
In water heeft het oplosbaarheden die variëren van 4,74 g/100 ml tot 0 ºC, tot 32,3 g/100 ml bij 100 ºC, wat kleurloze waterige oplossingen genereert. Bovendien is het onoplosbaar in alcohol en salpeterzuur, maar het is oplosbaar in verdund zwavelzuur.
De affiniteit voor water is niet merkbaar, wat verklaart waarom het niet hygroscopisch is en niet bestaat in de vorm van gehydrateerde zouten (Kio3· H2OF).
Oxidatiemiddel
Kalium Yodato, zoals aangegeven door zijn chemische formule, heeft drie zuurstofatomen. Dit is een sterk elektronegatief element en vanwege deze eigenschap laat het "ontdekt" een elektronisch wolkengebrek dat omringt jodium.
Kan u van dienst zijn: inerte gassenDit tekort - of bijdrage, naargelang het geval - kan worden berekend als het oxidatienummer van het jodium (± 1, +2, +3, +5, +7), is +5 in het geval van dit zout.
Wat betekent dit? Dat vóór een soort die in staat is hun elektronen te geven, jodium ze in hun ionische vorm zal accepteren (io3-) om moleculair jodium te worden en een oxidatienummer te hebben gelijk aan 0.
Na deze verklaring kan worden vastgesteld dat kaliumjodaat een oxiderende verbinding is die intens reageert met reducerende middelen in veel redoxreacties; Van al deze staat men bekend als een jodiumklok.
De jodiumklok bestaat uit een redox -proces van langzame en snelle stappen, waarin de snelle stappen worden gemarkeerd door een KIO -oplossing3 In zwavelzuur waaraan zetmeel wordt toegevoegd. Vervolgens werd de zetmeel -weer geproduceerd en verankerd onder zijn structuur de soort i3-- Het zal de kleurrijke blauwe oplossing voor donkerblauw maken.
Io3- + 3 HSO3- → i- + 3 HSO4-
Io3- + 5 i- + 6 H+ → 3 i2 + 3 H2OF
Je2 + HSO3- + H2O → 2 i- + HSO4- + 2 H+ (donkerblauw vanwege het zetmeel)
Chemische structuur
 Kalium yodato structuur
Kalium yodato structuur In het superieure beeld wordt de chemische structuur van kaliumjodaat geïllustreerd. Het io anion3- Het wordt vertegenwoordigd door het "statief" van rode en paarse bollen, terwijl de k -ionen+ Ze worden vertegenwoordigd door paarse bollen.
Maar wat betekenen deze statief? De juiste geometrische vormen van deze anionen zijn eigenlijk trigonale piramides, waarin de zuurstof de driehoekige basis vormen, en het niet-gescheiden koppel van jodiumpunten boven, het bezetten van de ruimte en het dwingen om de i-o-link en de twee links te vouwen en de twee links i = o.
Kan u van dienst zijn: wijnsteenzuurDeze moleculaire geometrie komt overeen met een SP -hybridisatie3 van het centrale atoom van jodium; Een ander perspectief suggereert echter dat een van de zuurstofatomen links vormt naar de orbitalen "d" van jodium, eigenlijk een hybridisatie van het spype3D2 (jodium kan zijn "D" -orbitalen hebben die zijn Valencia -laag uitbreiden).
De kristallen van dit zout kunnen lijden aan structurele fase -overgangen (andere regelingen dan monoklinisch) als gevolg van de verschillende fysieke aandoeningen die ze onderwerpen.
Gebruik en toepassingen van kaliumjodaat
Therapeutisch gebruik
Kalium yodato wordt meestal gebruikt om de accumulatie van radioactiviteit in de schildklier te voorkomen in de vorm van 131Ik, wanneer deze isotoop wordt gebruikt bij het bepalen van jodium door schildklier als onderdeel van de werking van de schildklier.
Evenzo wordt kalium yodato gebruikt als een actueel antisepticum (0,5 %) in slijmvliezen.
Gebruik in de industrie
Het wordt toegevoegd aan het voedsel van fokdieren als een jodiumsupplement. Daarom wordt kalium yodato in de industrie gebruikt om de kwaliteit van meel te verbeteren.
Analytisch gebruik
In analytische chemie wordt het dankzij de stabiliteit gebruikt als een primair patroon bij de standaardisatie van natriumthiosulfaatpatronen (NA2S2OF3), met als doel jodiumconcentraties te bepalen in de problemen problemen.
Dit betekent dat jodiumhoeveelheden bekend kunnen zijn door volumetrische technieken (graden). In deze reactie oxideert het kaliumjodaat snel naar de jodide -ionen i-, Door de volgende chemische vergelijking:
Kan u van dienst zijn: loodacetaat: structuur, eigenschappen, verkrijgen, gebruikIo3- + 5i- + 6h+ => 3i2 + 3H2OF
Het jodium, ik2, is getiteld met de NA -oplossing2S2OF3 voor de standaardisatie.
Gebruik in lasertechnologie
Studies hebben de interessante piëzo -elektrische, pyro -elektrische, elektro -elektrische, ferro -elektrische en niet -lineaire optica -eigenschappen van kiO -kristallen bevestigd en bevestigd3. Dit resulteert in grote potentialen in het elektronische veld en in de technologie van de lasers voor materialen gemaakt met deze verbinding.
Gezondheidsrisico's van kalium yodate
In hoge doses kan het irritaties veroorzaken in het orale slijmvlies, huid, ogen en luchtwegen.
De experimenten van de toxiciteit van het kaliumjodaat bij dieren hebben ons in staat gesteld te observeren dat bij honden in een snel, bij doses van 0,2-0,25 g/kg lichaamsgewicht, oraal geleverd, de verbinding veroorzaakt braken.
Als deze braken worden vermeden, produceert het bij dieren een verslechtering van hun situatie, omdat een anorexia en voorafgaand aan de dood wordt geïnduceerd. Zijn autopsies mochten necrotische leverlaesies, nieren en darmslijmvlies waarnemen.
Vanwege het oxiderende vermogen vormt het een risico op brand wanneer het in contact komt met ontvlambare materialen.
Referenties
- Dag, r., & Underwood, een. Kwantitatieve analytische chemie (Vijfde ed.)). Pearson Prentice Hall, P-364.
- Chemisch boek. (2017). Kaliumjodaat. Opgehaald op 25 maart 2018, van ChemicalBook: ChemicalBook.com
- Pubchem. (2018). Kaliumjodaat. Ontvangen op 25 maart 2018, van PubChem: PubChem.NCBI.NLM.NIH.Gov
- Merken. (2018). Kalium yodato. Ontvangen op 25 maart 2018, van Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Laadtransportmechanisme en fase van lage temperatuur in Kio3. J. Fysiek.: Conferen. Zijn. 423 012036

