Niet -metalen oxiden

- 2587
- 410
- Miss Herman Russel
 Koolstofdioxide is een broeikasgas en is ook een niet -metalen oxide
Koolstofdioxide is een broeikasgas en is ook een niet -metalen oxide Wat zijn niet -metalen oxiden?
De niet -metalen oxiden Het zijn binaire verbindingen gevormd tussen een niet -metaal met positieve oxidatietoestand en zuurstof met oxidatietoestand -2. Ook wel anhydriden en zuuroxiden genoemd, deze verbindingen vormen de neiging zure oplossingen te vormen door ze op te lossen in water, en hebben ook de neiging om te reageren met basisoxiden om oxisale zouten te vormen.
Niet -metalen oxiden zijn zeer gebruikelijk van aard. In feite zijn ze overal. Water, de vitale vloeistof die tweederde van het aardoppervlak bedekt, is een niet -metalen oxide. Zo zijn koolstofdioxide dat we uitademt tijdens onze ademhaling en zwaveloxiden die lucht verontreinigen en die zure regen veroorzaken.
Worden gevormd door niet -metalen en zuurstof (wat ook een niet -metaal is), zijn de banden die hun atomen verenigen covalente bindingen, in de meeste polaire gevallen. Om deze reden heeft de overgrote meerderheid van niet -metalen of anhydridoxiden aanzienlijk lage kookpunten, en veel van hen zijn gassen bij kamertemperatuur.
Niet -metalen oxiden eigenschappen
- Ze hebben geen glans of metaalachtige glans.
- Ze kunnen verschillende kleuren hebben.
- Hun atomen zijn verenigd door middel van covalente banden in plaats van ionische links.
- Ze worden gevormd door zuurstof en een niet -metaal.
- In vergelijking met metaaloxiden hebben ze meestal lage smelt- en kookpunten, hoewel zeer divers.
- De meeste zijn gassen, maar kunnen ook worden gevonden in vaste toestand (zoals n2OF3) of vloeistof bij kamertemperatuur.
- Vaste niet -metalen oxiden zijn meestal bros en kunnen verschillende hardheid hebben.
- Het zijn slechte geleiders van warmte en elektriciteit.
- Bij het oplossen van ze in water, reageren ze om oxacidzuren te vormen.
- Sommige van zijn oxacidzuren zijn sterke zuren die de neiging hebben anionen of oxyanions te vormen in waterige oplossing.
- Ze reageren met basisoxiden om oxisale zouten te vormen.
Soorten niet -metalen oxiden
Er is geen formele of universeel geaccepteerde classificatie van niet -metalen oxiden. Deze kunnen echter worden gegroepeerd op basis van hun zuur-base-eigenschappen.
Hoewel niet -metalen oxiden ook zuuroxiden worden genoemd, reageren ze niet allemaal als zuren tegen andere verbindingen. Gezien dit kunnen drie verschillende soorten niet -metalen oxiden worden geïdentificeerd volgens hun zuur/base -eigenschappen:
Niet -metalliczuuroxiden
Ze zijn de meest voorkomende. De overgrote meerderheid van verbindingen tussen zuurstof en een andere niet -metaal, ongeacht hun oxidatiestatus, produceert minerale zuren bij het oplossen van ze in water, wat aanleiding geeft tot zure oplossingen.
- Sommige voorbeelden van zuuroxiden zijn stikstofanhydride (n2OF5) en het zwavelanhydride (dus3)).
Neutrale niet -metalen oxiden
Sommige niet -metalen oxiden reageren helemaal niet met water bij het oplossen ervan. In deze gevallen is de resulterende oplossing neutraal (het is noch zuur noch basic).
- Enkele voorbeelden van neutrale oxiden zijn koolmonoxide (CO), stikstofoxide (N₂O) en chloordioxide (clo2)).
Niet -metalen amfotoreuze oxiden
De voorwaarde Anfótero Het verwijst naar het vermogen van een chemische verbinding om zich als een zuur of als een basis te gedragen, afhankelijk van wie reageert. Dat wil zeggen, dit zijn verbindingen die tegelijkertijd zuren en basen zijn.
- Onder de amfotische niet -metalen oxiden is de meest voorkomende water (h2OF). Het water is amfotent, omdat het in staat is om een proton aan een basis te geven (als een zuur), maar het is ook in staat om een proton van een zuur te ontvangen (als een basis).
Voorbeelden van niet -metalen oxiden
De meest voorkomende niet -metalen oxiden van elk niet -metaal worden hieronder gepresenteerd, samen met zijn moleculaire formule, de naam ervan volgens de systematische nomenclatuur van de IUPAC, volgens de stocknomenclatuur en volgens de traditionele nomenclatuur:
Koolstofoxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
CO | Koolmonoxide | Koolstofoxide (ii) | Carbonous Anhydride |
CO2 | Kooldioxide | Koolstofoxide (IV) | Koolhydride |
Stikstofoxiden
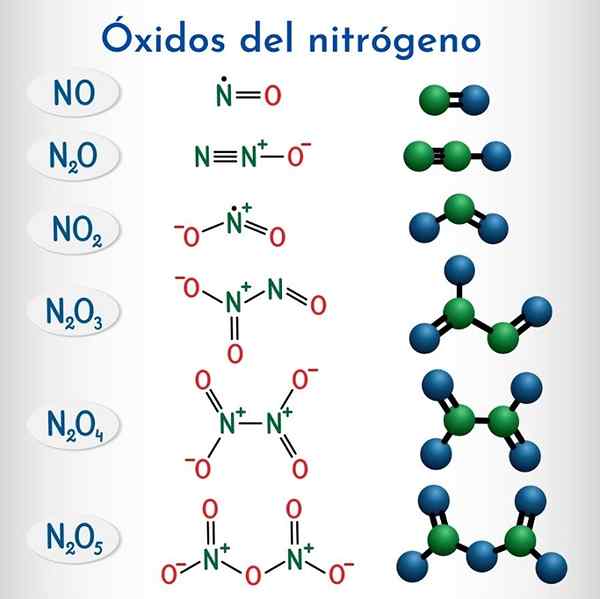 Formules en structuren van de 6 niet -metalen stikstofoxiden
Formules en structuren van de 6 niet -metalen stikstofoxiden Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
N2O | Dinitrogene monoxide | Stikstofoxide (I) | Lachgas (Hiponitroso anhydride) |
NEE | Stikstofmonoxide | Stikstofoxide (II) | Stikstofoxide |
N2O3 | Dinitrogene trioxide | Stikstofoxide (III) | Stikstofanhydride |
N2O4 | Dinitrogen tetraxide | Stikstofoxide (IV) | Stikstoftetraxide |
No2 | Stikstofdioxide | Stikstofoxide (IV) | Stikstofdioxide |
N2O5 | Dinitrogen pentaoxide | Stikstofoxide (V) | Stikstofanhydride |
Fosforoxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
P2O3 | Difosfacking -trioxide | Fosforoxide (III) | Fosforanhydride |
P2O5 | Difosfack pentaoxide | Fosforoxide (V) | Fosforanhydride |
P2O4 | Difosphack Tetraxide | Fosforoxide (III, V) | --- |
Arseenoxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
AS2O3 | Diarseentrioxide | Arseenoxide (III) | Arsenioso anhydride |
AS2O5 | Diarseen pentaoxide | Arseenoxide (V) | Arseenanhydride |
Antimoon oxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
SB2O3 | Duidelijke trioxide | Antimoonoxide (III) | Antimonious anhydride |
SB2O5 | Duidelijke pentaoxide | Antimoonoxide (V) | Antimonische anhydride |
Zwaveloxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
SW | Zwavelmonoxide | Zwaveloxide (II) | Hyposulfurous anhydride |
SO2 | Zwaveldioxide | Zwaveloxide (IV) | Zwavelanhydride |
SO3 | Zwaveltrioxide | Zwaveloxide (VI) | Zwavelanhydride |
Seleniumoxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
SEO | Seleniummonoxide | Seleniumoxide (ii) | Hypiploleneuze anhydride |
SEO2 | Seleniumdioxide | Seleniumoxide (iv) | Selsitaire anhydride |
SEO3 | Seleniumtrioxide | Seleniumoxide (VI) | Selénic -anhydride |
Telurio -oxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
Teo | Telurio monoxide | Telurio -oxide (II) | Hypelureus anhydride |
TEO2 | Telurio -dioxide | Telurio Oxide (IV) | Telurous anhydride |
TEO3 | Telurio -trioxide | Telurio Oxide (VI) | Telluric Anhydride |
Chlooroxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
Cl2o | Chloormonoxide | Chlooroxide (i) | Hypocloreus anhydride |
CL2O3 | Chloortrioxide | Chlooroxide (III) | Chlooranhydride |
CL2O5 | Chloor pentaoxide | Chlooroxide (V) | Chlooranhydride |
CL2O7 | Chloorheptoxide | Chlooroxide (vii) | Perchlooranhydride |
Broomoxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
BR2O | Broommonoxide | Broomoxide (i) | Hipobromous anhydride |
BR2O3 | Broomtrioxide | Broomoxide (iii) | Bromous anhydride |
BR2O5 | Broom pentaoxide | Broomoxide (v) | Bromic anhydride |
BR2O7 | Broom heptaoxide | Broomoxide (vii) | Perbromisch anhydride |
Jodiumoxiden
Formule | IUPAC Systematische naam | Voorraadnomenclatuur | Traditionele naam |
I2O | Jodiummonoxide | Jodiumoxide (i) | Hypoyodoso anhydride |
I2O3 | Jodiumtrioxide | Jodiumoxide (iii) | Yodoso Anhydride |
I2O5 | Jodium pentaoxide | Jodiumoxide (v) | Yodiumanhydride |
I2O7 | Jodiumheptoxide | Jodiumoxide (vii) | Periódicoic anhydride |

