Ethyleenoxidestructuur, eigenschappen, risico's en gebruik
- 5027
- 321
- James Dach
Hij ethyleenoxide Het is een organische verbinding van epoxidenfamilie. Bij kamertemperatuur is het gasvormig, kleurloos en, hoewel het bijna toilet is, heeft het een zachte zoete geur, vergelijkbaar met die van de ethers.
Het is een zeer veelzijdig chemisch bouwblok, omdat het wordt gebruikt in een breed scala aan industriële toepassingen voor de vervaardiging van andere chemische verbindingen met meerdere toepassingen. Dit komt door de hoge reactiviteit, dat wil zeggen, tot zijn gemak om met andere stoffen te reageren.
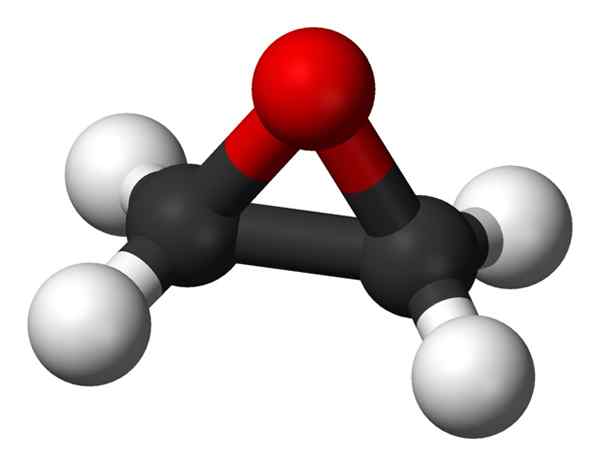
 Ruimtelijke structuur van ethyleenoxide. Zwarte ballen: koolstofatomen; Witte ballen: waterstofatomen; Rode bal: zuurstofatoom. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons.
Ruimtelijke structuur van ethyleenoxide. Zwarte ballen: koolstofatomen; Witte ballen: waterstofatomen; Rode bal: zuurstofatoom. Benjah-bmm27 [Public Domain]. Bron: Wikimedia Commons. Een van de belangrijkste toepassingen is als een grondstof bij de productie van de componenten van antivries voor voertuigradiatoren. De derivaten worden gebruikt als ingrediënten van industriële of huisreinigers, cosmetische producten en shampoos, kunststof, farmaceutische preparaten of zalven.
Het is een veelgebruikte desinfectiemiddel, bijvoorbeeld in de sterilisatie van medische en tandheelkundige apparatuur, omdat het in staat is om virussen, bacteriën, schimmels en sporen te vernietigen, vooral in droge omstandigheden. Bovendien is het gebruikt om voedingsproducten te fumeren voor uw verpakking, hoewel dit gebruik wordt ondervraagd.
Ondanks het nut, moet het met hoge voorzichtigheid worden gemanipuleerd, omdat het irritatie van de ogen en de huid kan veroorzaken. Het inademen van ethyleenoxide voor lange periodes kan het zenuwstelsel beïnvloeden. Daarom moeten mensen die worden blootgesteld aan hun dampen of oplossingen beschermende apparatuur en kleding gebruiken.
[TOC]
Structuur
De moleculaire formule is c2H4OF. Het behoort tot de groep epoxiden, die de eenvoudigste en belangrijkste hiervan is. Het heeft de vorm van een ring van drie leden.
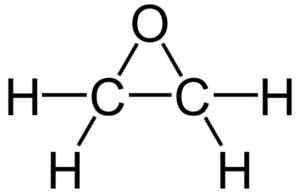 Ethyleenoxidestructuur. Bron: Wikimedia Commons
Ethyleenoxidestructuur. Bron: Wikimedia Commons Vanwege de driehoekige ringstructuur is ethyleenoxide zeer reactief, wat te wijten is aan het gemak waarmee de ring wordt geopend. Gemiddeld zijn de linkhoeken 60º, waardoor hun links zwak worden. Het molecuul is minder stabiel dan die van een lineaire ether en heeft de neiging gemakkelijk te reageren met andere chemische verbindingen.
Kan u van dienst zijn: natriumnitriet (nano2): structuur, eigenschappen, gebruik, risico'sEigenschappen
Andere namen
- Oxyran.
- Epoxietano.
Fysieke staat
Bij kamertemperatuur en onder atmosferische druk is het een gas. Onder 10,6 ºC en onder atmosferische druk is het een vloeistof. Onder -111 ºC is een vaste stof.
Molecuulgewicht
44.05 g/mol.
Flitslicht
Minder dan 0 ºF (-17,8 ºC).
Dikte
De dichtheid is minder dan die van water, met 0,882 tot 10 ºC. Op hun beurt zijn hun dampen zwaarder dan lucht.
Oplosbaarheid
Het is oplosbaar in water, benzeen, aceton, ethanol en ether. Het is mengbaar met koolstoftetrachloride.
Zelf -richtingtemperatuur
428,9 ºC.
Andere eigenschappen
- Als het verwarming of verontreiniging ondergaat, kan het exothermisch polymeriseren (een grote hoeveelheid warmte produceren). Als polymerisatie binnen een container optreedt, kan deze gewelddadig worden gebroken.
- Kan reageren met oxiderende materialen.
- Het is extreem giftig, carcinogeen en goede mutaties generator in bacteriën en zoogdiercellen.
Productie
Op industriële schaal wordt het bereid door oxidatie van ethyleen met zuurstof (of2) uit de lucht. De snelheid van deze reactie wordt verhoogd met de aanwezigheid van zilvermetaal (Ag) en temperatuuractie. Vervolgens wordt de reactie getoond:
AG, 250ºC
2 c2H4 + OF2 -> 2c2H4OF
Ethyleenethyleenoxide
Risico's
Tot de gezondheid
- Er is gemeld dat het neurologische aandoeningen produceert en dat de dood kan veroorzaken. De lagere concentratie die toxische effecten kan genereren door inademing is 12.500 ppm/10 seconden (ppm betekent: delen per miljoen).
- Het is een sterke irritante huid, ogen en luchtwegen.
Kan u van dienst zijn: Samario: kenmerken, structuur, verkrijgen, gebruik- Blootstelling aan damp met hoge concentratie ethyleenoxide kan oogirritatie, ontsteking van het oogmembraan en hoornvliesschade veroorzaken.
- De ontwikkeling van staar is geassocieerd met blootstelling aan hun dampen en spatten. Met geconcentreerde oplossingen is er ernstige schade aan de ogen.
- Het contact van waterige oplossingen van ethyleenoxide met de huid veroorzaakt irritatie en kan leiden tot ernstige dermatitis met ampullen en brandwonden.
- De inademing ervan kan het zenuwstelsel beïnvloeden, wat hoofdpijn en misselijkheid veroorzaakt, naast andere symptomen.
Vuur
- Bij blootstelling aan een vlam of warmte bestaat er een gevaar van explosie. Wanneer ze worden verwarmd, genereren ze gevaarlijke dampen.
- Stoom vormt explosieve mengsels met lucht in een breed scala van concentraties.
- Het moet worden vermeden te manipuleren met apparatuur die metalen bevat zoals koper, zilver, kwik, magnesium, aluminium of ijzeroxiden, evenals het vermijden van middelen zoals ammoniak, oxidatiemiddelen, zuren of organische basen, onder andere. Al deze materialen kunnen hun polymerisatie en/of explosie versnellen.
Toepassingen
Industriële toepassingen
Het wordt gebruikt als intermediair bij de productie van andere chemicaliën, die op hun beurt worden gebruikt bij de productie van polyestervezels voor kleding, bekleding, tapijten en kussens.
Met ethyleenoxide wordt ethyleenglycol gebruikt in antivries voor voertuigmotoren. Ethyleenglycol wordt ook gebruikt in de productie van glasvezel en plastic films voor verpakkingen.
Andere chemicaliën geproduceerd uit ethyleenoxide zijn niet -ionogene oppervlakteactieve stoffen die worden gebruikt in wasmiddelen en formules om de gerechten te wassen.
Kan u van dienst zijn: Isobutil: nomenclatuur, training, structuur en kenmerkenMedische toepassingen
Het wordt gebruikt als een sterilisatiemiddel van medische apparatuur, zoals chirurgische instrumenten, injectienaalden en injectoren of prothesen.
Het wordt ook gebruikt om machines te steriliseren voor hemodialyse, laboratoriumapparatuur, tandheelkundige instrumenten, veterinaire instrumenten, thermometers, chirurgische kleding of eerste hulpapparatuur, onder andere.
 Sterilisatieruimte. Bron: Pixabay.com
Sterilisatieruimte. Bron: Pixabay.com Hoewel er verschillende methoden beschikbaar zijn voor de sterilisatie van medische apparatuur, kan in sommige toepassingen geen beschikbare behandeling ethyleenoxide vervangen.
Dit is het geval van sterilisatie van bepaalde warmtegevoelige materialen en straling, evenals sommige instrumenten en artefacten die sterilisatie vereisen op de locatie van ziekenhuizen zelf.
Bibliotheken en musea
Op deze plaatsen wordt ethyleenoxide gebruikt om ongedierte zoals schimmels en insecten te regelen. Dit gebruik is echter niet zo gebruikelijk en wordt gebruikt wanneer andere alternatieven niet effectief zijn.
Landbouw en voedsel
Het is gebruikt als onder andere pesticide, fungicide, fumigant, herbicide, insecticide, rodenticide, onder andere varianten. Vermindert de populatie bacteriën en kruiden -schimmels aanzienlijk.
Vanwege de beveiliging en milieuproblemen is het gebruik van ethyleenoxide voor voedselbegering echter verboden in de Europese Unie en in de Verenigde Staten.
Referenties
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Ethhyleenoxide. Hersteld van PubChem.NCBI.NLM.NIH.Gov
- Feiten voor chemische veiligheid. (2019). Ethhyleenoxide. Hersteld van chemische faceteitjes.borg
- Morrison, Robert Thornton; en Boyd, Robert Neilson. 1992. Organische chemie. Prentice-Hall.
- Moerman, f. en mager, k. (2016). Reiniging en dissinfectie in droge voedselverwerkingsfaciliteiten. In Handbook of Hygiene Control in the Food Industry (tweede editie). Hersteld van Scientirect.com.
- Eastmond, David A. en Balakrishnan, Sharada. (2010). Genotoxy van pesticiden. In Hayes 'Handbook of Pesticide Toxicology (derde editie). Hersteld van Scientedirect.com
- Atungulu, g.G. en brood, z. (2012). Microbiële ontsmetting van noten en kruiden. Bij microbiële ontsmetting in de voedingsindustrie. Hersteld van Scientedirect.com
- « IJzeroxide (II) structuur, nomenclatuur, eigenschappen, gebruik
- Eenvoudige platte epitheelkenmerken, functies en typen »

