Strontiumoxide (SRO) structuur, eigenschappen, toepassingen
- 3534
- 622
- Nathan Wiegand
We leggen uit wat strontiumoxide, de chemische structuur, fysische en chemische eigenschappen, toepassingen en risico's is
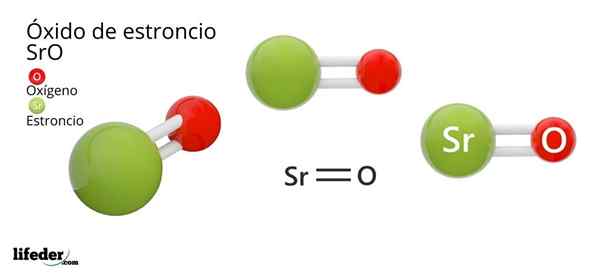
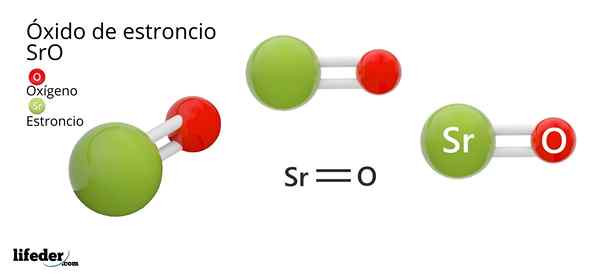
Hij Strontiumoxide, waarvan de chemische formule SRO is (niet te verwarren met strontiumperoxide, dat Sro2 is), is het product van de oxidatieve reactie tussen dit metaal en de zuurstof aanwezig in de lucht bij kamertemperatuur: 2SR (S) + O2 (g) → 2Sro (s).
Een stuk strontium brandt in contact met de lucht als gevolg van zijn hoge reactiviteit, en omdat het een elektronische configuratie van het NS2 -type heeft, leveren de twee valentie -elektronen gemakkelijk op, met name het diatome zuurstofmolecuul.
Als het oppervlak van het metaal wordt aangevuld door het te spuiten totdat het een fijn verdeeld poeder heeft, treedt de reactie onmiddellijk op en kan zelfs branden met een intense roodachtige vlam. Strontium, metaal dat deelneemt aan deze reactie, is een metaal van groep 2 van het periodiek systeem.
Deze groep bestaat uit de elementen die bekend staan als alkaline. De eerste van de elementen geleid door de groep is beryllium, gevolgd door magnesium, calcium, strontium, barium en ten slotte, de radio. Deze elementen zijn van metalen aard en, als een mnemonische regel om ze te onthouden, kan de uitdrukking worden gebruikt: “SR. Becambara ".
De "MR" waarnaar de uitdrukking verwijst, is niemand minder dan het metaalstrontium (SR), een zeer reactief chemisch element dat niet van nature in zijn pure vorm wordt gevonden, maar gecombineerd met andere elementen van de omgeving of zijn omgeving om aanleiding te geven Zijn zouten, nitriden en oxiden.
Om deze reden zijn mineralen en strontiumoxide de verbindingen waarin strontium in de natuur wordt gevonden.
[TOC]
Fysische en chemische eigenschappen van strontiumoxide
 Fysiek uiterlijk van strontiumoxide
Fysiek uiterlijk van strontiumoxide Strontiumoxide is een vaste witte, poreuze en toiletverbinding en kan, afhankelijk van de fysieke behandeling, in de markt worden gevonden als fijn stof, zoals kristallen of als nanodeeltjes.
Kan u van dienst zijn: oxidenHet molecuulgewicht is 103.619 g/mol en heeft een hoge brekingsindex. Het heeft fusiepunten (2531 ºC) en koken (3200 ° C), wat zich vertaalt in sterke linkinteracties tussen strontium en zuurstof. Dit hoge smeltpunt maakt het een thermisch stabiel materiaal.
Basisoxide
Het is een zeer basale oxide; Dit betekent dat het op kamertemperatuur reageert met water om strontiumhydroxide (SR (OH) 2) te vormen:
SRO (S) + H2O (L) → SR (OH) 2
Oplosbaarheid
Het reageert ook of behoudt vocht, essentieel kenmerk van hygroscopische verbindingen. Daarom heeft strontiumoxide een hoge reactiviteit met water.
In andere oplosmiddelen - bijvoorbeeld alcoholen zoals de ethanol van de apotheek of methanol - zijn enigszins oplosbaar; Terwijl in oplosmiddelen zoals aceton, ether of dichloormethaan, is het onoplosbaar.
Waarom is het zo? Omdat metalen oxiden -en nog meer die gevormd uit alkalinotherreuze metalen -polaire verbindingen zijn en daarom in betere mate interageren met polaire oplosmiddelen.
Het kan niet alleen reageren met water, maar ook met koolstofdioxide, het produceren van strontiumcarbonaat:
SRO (S) + CO2 (G) → SRCO3 (S)
Het reageert met zuren - zoals bijvoorbeeld verdund fosforzuur - om het zout- en waterfosfaatzout te produceren:
3Sro (S) + 2 H3PO4 (Dil) → SR3 (PO4) 2 (S) + 3H2O (G)
Deze reacties zijn exotherme, en daarom wordt het geproduceerde water verdampt door hoge temperaturen.
Chemische structuur
De chemische structuur van een verbinding legt uit hoe zijn atomen in de ruimte zijn. In het geval van strontiumoxide presenteert het een gemzouttype kristallijne structuur, hetzelfde tafelzout of natriumchloride (NaCl).
Kan u van dienst zijn: calciumbicarbonaatIn tegenstelling tot NaCl, is het monovalent zout -dat wil zeggen kationen en anionen van een grootte van belasting (+1 voor Na en -1 voor de Cl) -, de SRO is tweewaardig, met 2+ belastingen voor de SR, en van -2 voor O (O2-, oxide-anion).
In deze structuur wordt elk O2- (rood) ion omgeven door zes andere omvangrijke oxiden, die in zijn resulterende octaëdrische tussenruimten de Sr2+ -ionen (groene kleur), kleiner worden, kleiner. Deze verpakking of opstelling staat bekend als kubieke eenheidscel gecentreerd op gezichten (CCC).
Linktype
De chemische formule van strontiumoxide is SRO, maar verklaart niet absoluut de chemische structuur of het bestaande linktype.
In de vorige sectie werd vermeld dat het een GEMA -zoutstructuur presenteert; dat wil zeggen een veel voorkomende kristallijne structuur voor veel zouten.
Daarom is het type link overwegend ionisch, wat zou verduidelijken waarom dit oxide hoge fusie en kookpunten heeft.
Omdat de link ionisch is, zijn het de elektrostatische interacties die de atomen van strontium en zuurstof bij elkaar houden: SR2+ O2-.
Als deze binding covalent was, zou de verbinding kunnen worden weergegeven met links in zijn Lewis -structuur (het weglaten van de niet -gedeelde zuurstofelektronen).
Toepassingen
De fysieke eigenschappen van een verbinding zijn essentieel om te voorspellen wat hun potentiële toepassingen in de industrie zouden zijn; Daarom zijn dit een macro -reflectie van zijn chemische eigenschappen.
Hoofdvervanger
Strontiumoxide vindt, dankzij de hoge thermische stabiliteit, veel toepassingen in keramische, glas- en optiekindustrie.
Het gebruik ervan in deze industrieën is voornamelijk bedoeld om het lood te vervangen en een additief te zijn dat betere kleuren en viscositeiten verleent aan de grondstof van de producten.
Kan u van dienst zijn: HUREN HALOGENUROS: Eigenschappen, verkrijgen, voorbeeldenWelke producten? De lijst zou geen einde hebben, want in een van deze met glas, email, keramiek of kristallen in een van zijn stukken, kan strontiumoxide nuttig zijn.
Luchtvaartindustrie
Aangezien het een zeer poreuze vaste stof is, kan het kleinere deeltjes tussenbeide brengen en dus een reeks mogelijkheden bieden in de formulering van materialen, zoals licht om door de ruimtevaartindustrie te worden overwogen.
Katalysator
Dankzij diezelfde porositeit kun je potentieel gebruik hebben als katalysator (chemische reacties versneller) en als warmtewisselaar.
Elektronische doeleinden
Strontiumoxide dient ook als een productiebron van pure STRBAN voor elektronische doeleinden, dankzij het vermogen van dit metaal om x -reeks te absorberen; En voor de industriële voorbereiding van zijn hydroxide, SR (OH) 2, en zijn peroxide, SRO2.
Gezondheids risico's
Het is een corrosieve verbinding, dus het kan brandwonden veroorzaken met eenvoudig fysiek contact overal in het lichaam. Het is erg gevoelig voor vocht en moet worden opgeslagen in droge en koude ruimtes.
Het zoutenproduct van de reactie van dit oxide met verschillende zuren gedragen zich in het lichaam en als calciumzouten, en worden opgeslagen of uitgestoten door vergelijkbare mechanismen.
Op dat moment vertegenwoordigt strontiumoxide op zichzelf geen grotere gezondheidsrisico's.
Referenties
- Amerikaanse elementen. (1998-2018). Amerikaanse elementen. Hersteld van Amerikanen.com
- Shiver & Atkins. (2008). ANORGANISCHE SCHEIKUNDE. In de structuren van eenvoudige vaste stoffen (vierde ed., P. 84). MC Graw Hill.
- ATSDR. Hersteld van ASDR: ATSDR.CDC.Gov
- Clark, J. (2009). Chemguide. Hersteld van chemguide.co.Uk
- Tiwary, r., Narayan, s., & Pandey, of. (2007). Bereiding van stontiumoxide uit celestiet: een overzicht. Materials Science, 201211.

