Tinoxide (ii) structuur, eigenschappen, nomenclatuur, gebruik

- 3710
- 590
- Nathan Wiegand
Hij tinoxide (ii) Het is een kristallijne anorganische vaste stof die wordt gevormd door oxidatie van tin (Sn) door zuurstof, waarbij Tin Valencia 2 verwerft+. De chemische formule is sno. Twee verschillende manieren van deze verbinding zijn bekend: het zwart en de rode. De gemeenschappelijke en meest stabiele vorm bij kamertemperatuur is zwarte of zwart-blauwe aanpassing.
Deze vorm wordt bereid door tinchloride hydrolyse (II) (SNCL2) In waterige oplossing, waaraan ammoniumhydroxide wordt toegevoegd (NH4Oh) om een gehydrateerd oxide -neerslag te verkrijgen van Sn (ii) waarvan de formule sno is.XH2Of, waar x<1 (x menor que 1).
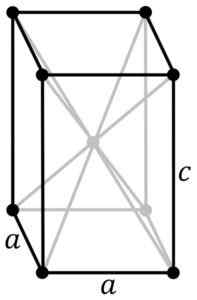 Tetragonale kristallijne structuur van de zwartblauwe sno. De SN -atoom bevindt zich in het midden van de structuur en zuurstofatomen in de hoekpunten van de parallellepiped. Originele PNG's door gebruiker: Rocha, getraceerd in Inkscape door gebruiker: Stannered [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]] Bron: Wikipedia Commons
Tetragonale kristallijne structuur van de zwartblauwe sno. De SN -atoom bevindt zich in het midden van de structuur en zuurstofatomen in de hoekpunten van de parallellepiped. Originele PNG's door gebruiker: Rocha, getraceerd in Inkscape door gebruiker: Stannered [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]] Bron: Wikipedia Commons Gehydrateerd oxide is een witte amorfe vaste stof, die vervolgens gedurende enkele uren in suspensie wordt verwarmd tot 60-70 ºC in aanwezigheid van NH4Oh, totdat je de zwarte kristallijne pure sno krijgt.
De rode vorm van de SNO is metastabiel. Het kan worden bereid door fosforzuur toe te voegen (h3Po4) - met 22% fosforzuur, h3Po3 - En dan NH4Oh een SNCL -oplossing2. De verkregen witte vaste stof wordt ongeveer 10 minuten in dezelfde oplossing verwarmd tot 90-100 ºC. Op deze manier wordt de zuivere rode kristallijne sno verkregen.
Tinoxide (II) is een uitgangsmateriaal voor de productie van andere tinverbindingen (ii). Om deze reden is het een van de tinverbindingen die een aanzienlijk commercieel belang heeft.
Tinoxide (II) presenteert lage toxiciteit zoals bij de meeste tin -ongebanische verbindingen. Dit komt door hun slechte absorptie en snelle uitscheiding van levende wezens stoffen.
Het kan je van dienst zijn: Bipe Beraral: wat is, kenmerken, waar is het voorPresenteert een van de grootste toleranties van tinverbindingen in tests uitgevoerd met ratten. Het kan echter schadelijk zijn als het in grote hoeveelheden wordt ingeademd.
[TOC]
Structuur
Tinoxide (ii) zwart-blauw
Deze modificatie kristalliseert met tetragonale structuur. Het heeft een laag op rangschikking.
Andere onderzoekers bevestigen dat elke SN -atoom is omgeven door 5 zuurstofatomen die ongeveer in de hoekpunten van een octaëder zijn, waar het zesde hoekpunt vermoedelijk wordt bezet door een paar vrije of niet gepaarde elektronen. Dit staat bekend als de φ-octische opstelling.
Rood tinoxide (ii)
Deze vorm van tinoxide (II) kristalliseert met ortorrombische structuur.
Nomenclatuur
- Tinoxide (ii)
- Estany -oxide
- Tinmonoxide
- Estany -oxide
Eigenschappen
Fysieke staat
Kristallijne vaste stof.
Molecuulgewicht
134.71 g/mol.
Smeltpunt
1080 ºC. Het ontleedt.
Dikte
6.45 g/cm3
Oplosbaarheid
Onoplosbaar in koud of heet water. Onoplosbaar in methanol, maar het lost snel op in zuren en geconcentreerde alkalis.
Andere eigenschappen
Als meer dan 300 ºC wordt verwarmd in aanwezigheid van lucht, wordt het tinoxide (II) snel geoxideerd in tinoxide (iv) de incandescentie vertonen.
Er is gemeld dat onder niet-oxiderende omstandigheden tinoxide (II) verwarming verschillende resultaten heeft volgens de zuiverheid van het startoxide. Het is over het algemeen onevenredig in metallic SN en tinoxide (iv), sno2, Met verschillende tussenliggende soorten die eindelijk sno worden2.
Tinoxide (II) is amfotero, omdat het in zuren wordt opgelost om snaringen te geven2+ of anions-complexen, en lost ook op in alkalis om hydroxy-stanning ionoplossingen te vormen, SN (OH)3-, die een piramidale structuur hebben.
Het kan u van dienst zijn: perchloorzuur: formule, kenmerken en gebruikBovendien is de SNO een reductiemiddel en reageert snel met organische zuren en mineralen.
Het presenteert lage toxiciteit in vergelijking met andere tinnen zouten. De DL50 (50% dodelijke dosis of medium dodelijke dosis) bij ratten is meer dan 10000 mg/kg. Dit betekent dat meer dan 10 gram per kilogram vereist is om 50% van de rattenspecimens te doden onder een bepaalde proefperiode. Ter vergelijking, tinfluoride (II) presenteert een 188 mg/kg DL50.
Als het echter lange tijd wordt ingeademd, wordt het in de longen afgezet omdat het niet wordt geabsorbeerd en tin kan produceren (infiltratie van het SNO -stof in de long tussenliggende stoffen).
Toepassingen
Bij de productie van andere tinnenverbindingen (ii)
De snelle reactie met zuren is de basis van het belangrijkste gebruik, dat is als intermediair bij de productie van andere tinverbindingen.
Het wordt gebruikt bij de productie van tinbromide (ii) (snbr2), Tin cyanide (II) (SN (CN)2) en tin fluoroboraat hydraat (ii) (sn (bf4))2), Onder andere tinverbindingen (ii).
Tin fluoroboraat (ii) wordt bereid door snam op te lossen. Dit is onder andere te wijten aan de capaciteit van hoge dekking.
Tin (ii) oxide wordt ook gebruikt in tinsulfaatbereiding (II) (SNSO4), door Sno en zwavelzuurreactie, h2SW4.
De SNSO4 Verkregen, wordt het gebruikt in het ingeblikte proces voor de productie van gedrukte circuitplaten, voor de elektrische contactafwerking en voor de keukengerei.
Kan u van dienst zijn: aluminium carbonaat: structuur, eigenschappen, gebruik Gedrukt circuit. Geen machine-leesbare auteur verstrekt. Abraham del Pozo Aangenomen (op basis van auteursrechtclaims). [Public Domain] Bron: Wikimedia Commons
Gedrukt circuit. Geen machine-leesbare auteur verstrekt. Abraham del Pozo Aangenomen (op basis van auteursrechtclaims). [Public Domain] Bron: Wikimedia Commons De gehydrateerde vorm van de Sno, de tin hydrotado (ii) sno.XH2Of het wordt behandeld met fluorhorinezuur om tinfluoride te verkrijgen (II), SNF2, die wordt toegevoegd aan dentifric crèmes als agent om cariës te bestrijden.
In sieraden
Tinoxide (II) wordt gebruikt bij de bereiding van kristallen van goudstraat en koper-stompjes. Blijkbaar is de functie in deze toepassing om te fungeren als een reductiemiddel.
 Jewel met Ruby. Bron: Pixabay
Jewel met Ruby. Bron: Pixabay Andere gebruiken
Het is gebruikt in fotovoltaïsche apparaten voor de productie van elektriciteit uit licht, zoals zonnecellen.
 Fotovoltaïsch apparaat. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licenties/by-sa/2.5)] Bron: Wikipedia Commons
Fotovoltaïsch apparaat. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licenties/by-sa/2.5)] Bron: Wikipedia Commons Recente innovaties
Sno-geordende nanodeeltjes zijn gebruikt in koolstof nanobuisjes elektroden voor lithium-suikerbatterijen.
 Sno Hydrateer nanovezels. Fionán [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Bron: Wikipedia Commons
Sno Hydrateer nanovezels. Fionán [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Bron: Wikipedia Commons SNO voorbereide elektroden vertonen een hoge geleidbaarheid en weinig verandering in volume in repetitieve laden en downloadcycli.
Bovendien vergemakkelijkt de SNO een snelle ionen/elektronenoverdracht tijdens oxidatie-reductiereacties die optreden in het dergelijke batterijsysteem.
Referenties
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Dans, j.C.; Emeléus, h.J.; Sir Ronald Nyholm en Trotman-Deckenson,.F. (1973). Uitgebreide anorganische chemie. Deel 2. Pergamon Press.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. Deel A27. VCH VerlagSgellschaft MBH.
- Kirk-othmer (1994). Encyclopedie van chemische technologie. Deel 24. Vierde druk. John Wiley & Sons.
- Ostrakhovitch, Elena to. En Cherian, m. George. (2007). Blik. In Handbook of the Toxicology of Metals. Derde editie. Hersteld van Scientedirect.com.
- Kwestroo, W. en Vromans, p.H.G.M. (1967). Bereiding van drie modificaties van zuiver tin (ii) oxide. J. Inorged. Knorren. Chem., 1967, vol.29, pp.2187-2190.
- Foud, s.S et al. (1992). Optische eigenschappen van dunne stanne oxide -films. Tsjechoslowak Journal of Physics. Februari 1992, Volume 42, nummer 2. Hersteld van Springer.com.
- A-Young Kim et al. (2017). Geordende SNO-nanodeeltjes in MWCNT als functioneel hostmateriaal voor hoogrente lithium-zwavelbatterijbatterij kathode. Nano Research 2017, 10 (6). Hersteld van Springer.com.
- Nationale bibliotheek van geneeskunde. (2019). Stanne oxide. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- « Jacquard Loom geschiedenis, operatie, gebruik
- Functionalisme (architectuur) geschiedenis, kenmerken, werken »

