Bariumoxide (BAO) structuur, eigenschappen, gebruik, risico's

- 3721
- 714
- Ernesto McKenzie
Hij bariumoxide Het is een anorganische vaste stof gevormd door een bariumatoom (BA) en een zuurstof (O) atoom. De chemische formule is bao. Het is een witte kristallijne vaste stof en is hygroscopisch, dat wil zeggen, het absorbeert het vocht van de lucht, maar daarmee reageert het hiermee.
De snelle reactie van bariumoxide met water maakt het gebruikt in chemische analyse -laboratoria, dat wil zeggen, het elimineren van water uit organische oplosmiddelen, die vloeibare verbindingen zijn die dienen om andere stoffen op te lossen.
 Vast bao bariumoxide. Lem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons.
Vast bao bariumoxide. Lem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Bron: Wikimedia Commons. Bao gedraagt zich als een sterke basis en reageert daarom met veel soorten zuren. Bijvoorbeeld reageren gemakkelijk met koolstofdioxide2 van de lucht om bariumcarbonaat Bacchus te vormen3.
Het dient in de productie van polymeren voor elektriciteitskabels en als een ingrediënt van de harsen om tandengaten af te sluiten die zijn genezen.
Bariumoxide (BAO) wordt ook gebruikt in de keramische industrie, beide om het te dekken met beglazing als om het te produceren. Het wordt ook gebruikt in cementmengsels om de compressieweerstand van het eindproduct te vergroten.
[TOC]
Structuur
Bao Baar Oxide wordt gevormd door een kation BA2+ en een zuurstofanion of2-.
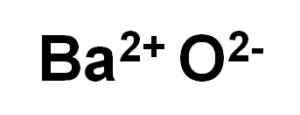 Bao bariumoxide -ionen. Auteur: Marilú Stea.
Bao bariumoxide -ionen. Auteur: Marilú Stea. In zijn kristallen vormt de Bao kubieke ionische netwerken (in de vorm van een kubus) van het natriumchloride -type.
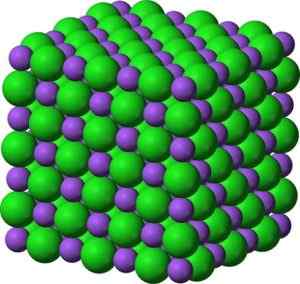 Bao -bariumoxide -vormige kristallijne structuur vergelijkbaar met natriumchloride. Groen: barium. Blauw: zuurstof. Benjah-BMM27 (Talk · Contribs) [Public Domain]. Bron: Wikimedia Commons.
Bao -bariumoxide -vormige kristallijne structuur vergelijkbaar met natriumchloride. Groen: barium. Blauw: zuurstof. Benjah-BMM27 (Talk · Contribs) [Public Domain]. Bron: Wikimedia Commons. De elektronische configuratie van het bariumion is: [xe] 6s0 Nou, de twee elektronen van de 6s -laag zijn verloren. Deze configuratie is erg stabiel.
Nomenclatuur
-Bariumoxide
-Bariummonoxide
Het kan u van dienst zijn: Test: kenmerken, typen, voorbeelden van gebruikFysieke eigenschappen
Fysieke staat
Geelachtig witte kristallijne vaste stof.
Molecuulgewicht
153.33 g/mol
Smeltpunt
1923 ºC
Kookpunt
Ongeveer 2000 ºC.
Dikte
5.72 g/cm3
Oplosbaarheid
Little water oplosbaar: 3,8 g/100 ml bij 20 ºC.
Chemische eigenschappen
Bario Bao -oxide reageert snel2, dat is het meest oplosbare hydroxide tussen alkalinetrische metaalhydroxiden.
Bao + h2O → ba (oh)2
Bao is een sterke basis. Reageert exotherme (dat wil zeggen met warmte -detachement) met alle soorten zuren.
Met CO2 Bao reageert op bariumcarbonaat Bacchus3.
Bao + co2 → Bacchus3
Bao is hygroscopisch, want als het naar het milieu is toegestaan, wordt het geleidelijk samengevoegd met het vocht van de lucht, waardoor BA wordt gevormd (OH)2 die wordt gecombineerd met koolstofdioxide2 van de lucht om bariumcarbonaat Bacchus te geven3.
Wanneer het Bao -bariummonoxide wordt verwarmd in aanwezigheid van lucht, wordt het gecombineerd met zuurstofvormende bariumperoxide Bao2. De reactie is omkeerbaar.
2 Bao + O2 ⇔ 2 Bao2
In aanwezigheid van water kan het reageren met aluminium op de of met FIFC Zn die de oxiden of hydroxiden van deze metalen vormt en waterstofgas H genereert2.
U kunt polymerisatie van organische verbindingen initiëren die kunnen worden gepolymeriseerd, zoals epoxiden.
Risico's
Het kan giftig zijn door inname. U moet geen contact opnemen met de huid. Het irriterende ogen, huid en luchtwegen. Het kan schadelijk zijn voor het zenuwstelsel. Het is in staat om lage niveaus van kalium te veroorzaken, wat resulteert in hart- en spieraandoeningen.
Het verkrijgen van
Bao -bariumoxide kan worden verkregen door het Bario Baco -carbonaat te verwarmen3 Met steenkool. Bao wordt gevormd en koolmonoxidegas wordt vrijgegeven.
Bacchus3 + C → Bao + 2 CO ↑
Toepassingen
Als droogmiddel van organische oplosmiddelen
Vanwege het gemak om met water te reageren, wordt BAO sinds het midden van de vorige eeuw gebruikt als uitdraag.
Het kan u van dienst zijn: cyanhydriczuur: moleculaire structuur, eigenschappen, gebruikDe Bao is erg actief om er omheen te drogen, het kost vocht heel snel, met de evolutie van vrij warmte, waardoor bariumhydroxide BA (OH) wordt gevormd (OH)2 die stabiel is tot ongeveer 1000 ºC. Daarom kan de BAO bij hoge temperaturen worden gebruikt.
Het heeft ook een hoge waterabsorptiecapaciteit. Voor elk BAO -molecuul kan men een water absorberen en de BA (OH)2 resulterend kan ook een bepaalde hoeveelheid water absorberen.
Het is geschikt voor analytische chemielaboratoria. Het is niet plakkerig.
Het kan worden gebruikt in destigatoren, die grote glazen containers zijn met deksel waar de droge interne atmosfeer wordt gehandhaafd. De Bao houdt de miniatmosfeer van de deparcator droog.
 Distiners in een laboratorium. De droogbare vaste stof zoals Bao wordt onderaan de basis geplaatst. De originele uploader was Rifleman 82 bij Engelse Wikipedia. [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons.
Distiners in een laboratorium. De droogbare vaste stof zoals Bao wordt onderaan de basis geplaatst. De originele uploader was Rifleman 82 bij Engelse Wikipedia. [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Bron: Wikimedia Commons. Deze ontwerpers dienen om stoffen of reagentia te plaatsen en voorkomen dus dat ze water uit de omgeving absorberen.
Het dient ook om basisgassen zoals ammoniak NH te drogen3.
In downloadlampen
De BAO wordt in de elektroden van de afvoerlampen geplaatst als een elektronemateriaalmateriaal.
Afvoerlampen worden gevormd door een glazen buis, kwarts of ander geschikt materiaal, bevatten een inert gas en in de meeste gevallen een metalen damp. Metallic stoom kan natrium of kwik zijn.
 Kwiklamp. Dmitry G [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Kwiklamp. Dmitry G [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. In de buis treedt elektrische schok op omdat deze een positieve en een negatieve elektrode heeft.
Bao wordt in lampelektroden geplaatst. De uitgestoten elektronen botsen met de metalen stoomatomen en brengt energie over.
Het kan u van dienst zijn: KUPRIC OXIDE (CUO)Bij het passeren van een elektrische stroom door dit gas of stoom is er zichtbaar licht of ultraviolette straling (UV).
In keramische productie
Bao wordt gebruikt in geglazuurde keramische coatingcomposities.
 Coated gebouwgevel met geglazuurde keramiek. Penny Mayes/geglazuurde gevel. Bron: Wikimedia Commons.
Coated gebouwgevel met geglazuurde keramiek. Penny Mayes/geglazuurde gevel. Bron: Wikimedia Commons. Het is echter ook getest als een additief bij de voorbereiding van de kookplaat.
Bao verbetert effectief de mechanische kenmerken en chemische resistentie van dit type keramiek. Het heeft een sterke invloed op thermische eigenschappen en de samenstelling van de kristallijne fase van de verkregen materialen.
Bij de voorbereiding van cementmengsels
Bao is getest als een component van fosfoaluminaatcement.
Dit type cement is nuttig in mariene omgevingen, omdat het niet dezelfde neiging heeft om te hydrateren als andere soorten cement, dus het lijdt niet aan porie of expansie.
Fosfoaluminatie -cementen moeten echter worden versterkt in hun mechanische prestaties om mariene stromingen en slagen van zwevende stukken ijs in de oceaan te kunnen weerstaan.
De toevoeging van BAO aan het fosfoaluminatiecement modificeert de minerale structuur van genoemd materiaal, verbetert de structuur van de poriën en verhoogt de drukkracht van cementpasta aanzienlijk.
Met andere woorden, Bao verbetert de compressieweerstand van dit type cement.
 Meng voor beton. Bao -bariumoxide is nuttig om bepaalde cementeigenschappen te verbeteren. ThamizhpParithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons.
Meng voor beton. Bao -bariumoxide is nuttig om bepaalde cementeigenschappen te verbeteren. ThamizhpParithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Bron: Wikimedia Commons. In verschillende toepassingen
Het wordt gebruikt als een ingrediënt om dekking te bieden in tandheelkundige harsen voor het vullen van gaten in de tanden, uitgevoerd door tandartsen.
Het wordt ook gebruikt als een nucleatie -middel voor het bereiden van polyvinylideen fluoridepolymeren die worden gebruikt om elektriciteitskabels te isoleren.
Referenties
- Partyka, J. et al. (2016). Effect van toevoeging van Bao op het sinteren van glas-keramische materialen van SIO2-Naar de2OF3-NA2OKÉ2O-cao/mgo-systeem. J Therm Anal Calim (2016) 125: 1095. Link hersteld.Springer.com.
- Zhang, p. et al. (2019). Effect van BAO op minerale structuur en hydratatiegedrag van fosfoaluminaatcement. J Therm Anal Calim (2019) 136: 2319. Link hersteld.Springer.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Oxidebarium. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Smith, n.NAAR. (2003). Verlichting. Beginsel. In het referentieboek van elektrotechnisch ingenieur (zestiende editie). Hersteld van Scientedirect.com.
- Ebnejjad, s. (2003). Fluorpolymeerschuimen. PVDF schuimen. In smelt -verwerkbare fluoroplastics. Hersteld van Scientedirect.com.
- Booth, h.S. en McIntyre, L.H. (1930). Bariumoxide als een disicent. Ind. Eng. Chem. Anaal. ED. 1930, 2, 1, 12-15. Hersteld van pubs.ACS.borg.
- « Natriumcyanide (NACN) structuur, eigenschappen, risico's, gebruik
- De 15 beste voedingsmiddelen om billen te vergroten (natuurlijk) »

