Zwaveloxide
- 3139
- 817
- Irving McClure I
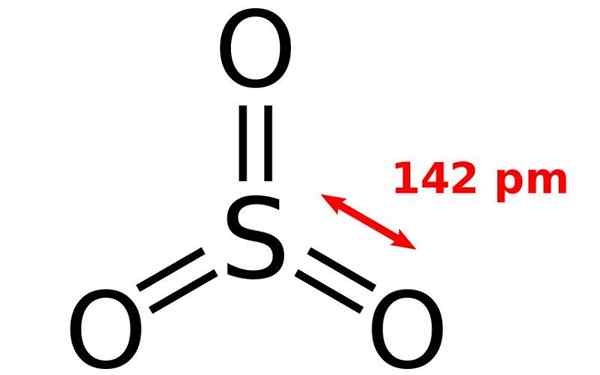
 Chemische structuur van het zwaveloxidemolecuul. Bron: Joel Holdsworth, Wikimedia Commons
Chemische structuur van het zwaveloxidemolecuul. Bron: Joel Holdsworth, Wikimedia Commons Wat is zwaveloxide?
Hij zwaveloxide (Vi), ook bekend als zwavel- of zwavelanhydride -trioxide, is een chemische verbinding van formule S3, Dat het onder normale omstandigheden een kleurloze en vezelachtige vaste stof is, en bij 25 ° C en 1 atm is een krachtig vervuilingsmiddel, verantwoordelijk voor zure regen.
Zwaveltrioxide wordt geproduceerd door de oxidatie van zwaveloxid.
Tot nu toe echter het enige pure zwaveltrioxide -bereiding van gassen die bevatten3 Verdund, het is een proces geweest op een pilootplantschaal dat cryoscopische condensatie impliceert.
De gebruikelijke procedure impliceert in plaats daarvan oliedistillatie. De warmte die nodig is voor olieverdestillatie wordt gemakkelijker geleverd door heet contactgas van de bijbehorende zwavelzuurinstallatie.
Het kan in het laboratorium worden bereid door rokende zwavelzuur te verwarmen en gesublimeerd te verzamelen in een gekoelde ontvanger. Als de stoom is gecondenseerd boven 27 ° C, wordt de gamma -vorm verkregen als een vloeistof.
Als de stoom onder 27 ° C is gecondenseerd en in aanwezigheid van een vochtigheidslijn wordt verkregen, wordt een mengsel van de drie vormen verkregen. De 3 vormen kunnen worden gescheiden door fractionele destillatie.
Het verbranden van fossiele brandstoffen is de oorzaak van het uiterlijk in de atmosfeer, dit is de belangrijkste antropogene oorzaak.
Fysische en chemische eigenschappen van zwaveloxide
- Zwaveltrioxide heeft de vorm van witte naalden die rook in de lucht worden. U komt vaak remmers tegen om polymerisatie te voorkomen.
Kan u van dienst zijn: Renio: ontdekking, eigenschappen, structuur, gebruik- Het molecuulgewicht is 80.066 g/mol, de dichtheid is 1,92 g/cm³ g/ml en de fusie- en kookpunten zijn respectievelijk 16,8 ° C en 44,7 ° C.
- De verbinding wordt gecombineerd met water met explosieve kracht, waardoor zwavelzuur wordt gevormd vanwege de zuurgraad. Carboniza zwaveltrioxide organische stoffen.
- Zwaveltrioxide absorbeert snel vocht en straalt dichte witte dampen uit. Zwavelzuurtrioxide -oplossingen worden rookzwavelzuur of olie genoemd.
- De zwaveltrioxide -reactie en zuurstofdiffluoride is erg krachtig en explosies worden geproduceerd als de reactie wordt uitgevoerd in afwezigheid van een oplosmiddel.
- De overtollige zwaveltrioxide -reactie met tetrluorethyleen veroorzaakt de explosieve ontleding van carbonylfluoride en zwaveldioxide.
- De reactie van het watervrij perchloorzuur met zwaveltrioxide is gewelddadig en gaat gepaard met de evolutie van aanzienlijke warmte. Vloeibaar zwaveltrioxide reageert gewelddadig met nitrilchloride, zelfs 75 ° C.
- De zwaveltrioxide -reactie en loodoxide veroorzaakt witte luminescentie. De combinatie van jodium, pyridine, zwavel en formamide -trioxide ontwikkelde na enkele maanden een gas op druk op druk.
Dit is te wijten aan de langzame vorming van zwavelzuur, extern water of uitdroging van waterstofcyanide -formamide.
Risico's
Zwaveltrioxide is een stabiele verbinding, onverenigbaar met organische materialen, fijn gepoederde metalen, basen, water, cyaniden en een breed scala aan andere chemicaliën.
De substantie is een sterk oxidatiemiddel en reageert gewelddadig met brandbare materialen en organisatoren en organische verbindingen die brand en explosie veroorzaken.
Kan u van dienst zijn: natriumoxalaat (NA2C2O4): structuur, eigenschappen, gebruik, risico'sReageert heftig met nat water en lucht om zwavelzuur te produceren. De oplossing in water is een sterk zuur, het reageert gewelddadig met basen en corrosieve metalen, waardoor brandbaar / explosief gas wordt gevormd.
De verbinding is corrosief voor metalen en weefsels. Veroorzaakt brandwonden in de ogen en de huid. Inname veroorzaakt ernstige brandwonden in de mond, slokdarm en maag. De stoom is erg giftig door inademing.
In geval van oogcontact moet u controleren of contactlenzen worden gebruikt en deze onmiddellijk verwijderen. De ogen moeten minimaal 15 minuten worden gespoeld met stromend water, waardoor de oogleden open blijven. Koud water kan worden gebruikt, zonder oogzalf aan te brengen.
Als de chemische stof in contact komt met de kleding, behoudt deze dan zo snel mogelijk en beschermt het zijn eigen handen en lichaam. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt in de blootgestelde huid van het slachtoffer, zoals de handen, wordt de huid besmet met stromend water en niet -schaapszeep zacht gewassen en voorzichtig. Koud water kan worden gebruikt. Als irritatie aanhoudt, zoek dan medische aandacht. Was besmette kleding voordat u het opnieuw gebruikt.
In het geval van inhalatie moet het slachtoffer in een goed geventileerd gebied worden toegestaan. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilig gebied worden geëvacueerd. Losse strakke kleding, zoals shirthals, riemen of stropdas.
Als het slachtoffer moeilijk te ademen is, moet zuurstof worden toegediend. Als het slachtoffer niet ademt, wordt een mondreanimatie van de mond gemaakt. Altijd rekening houdend dat het gevaarlijk kan zijn voor de persoon die hulp biedt om mond aan mondreanimatie te geven wanneer het geïnhaleerde materiaal giftig, besmettelijk of corrosief is.
Het kan u van dienst zijn: hypofysezuur (H3PO2): eigenschappen, gebruik en reagentiaIn alle gevallen moet onmiddellijk medische hulp worden gevraagd.
Aan de andere kant is luchtvervuiling als gevolg van zwaveloxiden een belangrijk omgevingsprobleem, met miljoenen tonnen zwaveldioxide en trioxide die elk jaar naar de atmosfeer worden uitgestoten. Deze verbindingen zijn schadelijk voor het planten- en dierenleven, evenals voor veel bouwmaterialen.
Een ander groot probleem om te overwegen is zure regen. Beide zwaveloxiden lossen op in atmosferische waterdruppels om zure oplossingen te vormen, wat zeer schadelijk kan zijn wanneer ze in de vorm van regen vallen.
Zure regen kan bossen beschadigen en ervoor zorgen dat vissen in veel meren sterven. Het is ook corrosief voor metalen, kalksteen en andere materialen. De mogelijke oplossingen voor dit probleem zijn duur vanwege de moeilijkheid om de zwavel van steenkool en olie te elimineren voordat ze branden.
Toepassingen
- Zwaveltrioxide is een essentieel reagens in sulfonatiereacties. Deze processen bieden wasmiddelen, kleurstoffen en farmaceutische producten. Het wordt in situ gegenereerd door zwavelzuur of gebruikt als een rokende zwavelzuuroplossing.
- De desinfecterende eigenschappen zijn voor eeuwen verantwoordelijk om te worden gebruikt om de wijnblokjes te desinfecteren, waardoor zwavel erin verbrandt.
Referenties
- Trioxide zwavel. Hersteld van EBI.AC.Uk
- Veiligheidsgegevensblad Zwaveltrioxide. Hersteld van Sciencelab.com

