Vervluchtiging

- 1882
- 195
- Aaron Okuneva
 Wanneer water in een plaat wordt verwarmd totdat damp optreedt, treedt de volatilisatie op. Met licentie
Wanneer water in een plaat wordt verwarmd totdat damp optreedt, treedt de volatilisatie op. Met licentie Wat is vervluchtiging?
De vervluchtiging Het is het proces van het omzetten van een chemische stof van een vloeibare of vaste toestand naar een gasvormige of stoom. Andere termen die worden gebruikt om hetzelfde proces te beschrijven, zijn verdamping, destillatie en sublimatie.
Een stof kan vaak van een andere worden gescheiden door vervluchtiging en kan worden teruggewonnen door stoomcondensatie.
De stof kan sneller worden vervlogen, hetzij verwarmen om de stoomdruk te verhogen of door stomen, met behulp van een inerte gasstroom of een vacuümpomp.
Verwarmingsprocedures omvatten de vervluchtiging van water, kwik of arseen trichloride om deze stoffen van de interferentiële elementen te scheiden.
Soms worden chemische reacties gebruikt om vluchtige producten te produceren, zoals bij de afgifte van koolstofdioxide uit carbonaten, ammoniak in de Kjeldahl -methode voor de bepaling van stikstof- en zwaveldioxide bij de bepaling van stalen zwavel.
Vervlantilisatiemethoden worden in het algemeen gekenmerkt door grote eenvoud en werkgemak, behalve wanneer zeer resistent tegen corrosiebestendig of materialen nodig zijn.
Vluchting van de dampdruk
Wetende dat de kooktemperatuur van water op 100 ° C is, is het relevant om te vragen waarom regenwater verdampt. Als het op 100 ° C is, zou het ons warmte moeten geven.
Het is ook de moeite waard om te vragen wat het karakteristieke aroma geeft aan alcohol, azijn, hout of plastic.
De persoon die verantwoordelijk is voor dit alles is een eigenschap die bekend staat als stoomdruk, die de druk is die wordt uitgeoefend door een stoom in evenwicht met de vaste of vloeibare fase van dezelfde stof. Ook de gedeeltelijke druk van de stof in de atmosfeer op de vaste stof of vloeistof.
De stoomdruk is een maat voor de neiging van een materiaal dat moet worden gewijzigd in de gasvormige of stoomstatus, dat wil zeggen een maat voor de volatiliteit van de stof.
Het kan u van dienst zijn: koolstofdisulfide (CS2): structuur, eigenschappen, gebruik, risico'sNaarmate de stoomdruk toeneemt, hoe groter de capaciteit van de vloeistof of de vaste stof om te verdampen, waardoor het dus vluchtiger is.
De stoomdruk zal toenemen met de temperatuur. De temperatuur waarbij de stoomdruk op het oppervlak van een vloeistof gelijk is aan de druk die door de omgeving wordt uitgeoefend, wordt het vloeibare kookpunt genoemd.
De stoomdruk hangt af van de opgeloste opgeloste oplossing (het is een coligatieve eigenschap). Op het oppervlak van de oplossing (lucht-lage interface), hebben de meest oppervlakkige moleculen de neiging om te verdampen, uit te wisselen tussen fasen en stoomdruk te genereren.
De aanwezigheid van opgeloste stof vermindert het aantal oplosmiddelmoleculen op het grensvlak, waardoor de stoomdruk wordt verlaagd.
De verandering in de stoomdruk kan worden berekend met de wet van Raalault voor niet -vluchtige opgeloste stoffen, die wordt gegeven door:
(1)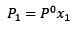 Waar P1 de stoomdruk is na het toevoegen van de opgeloste.
Waar P1 de stoomdruk is na het toevoegen van de opgeloste.
Als de som van de molaire fracties van de opgeloste stof en oplosmiddel gelijk is aan 1, hebben we:
(2)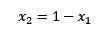
Waarbij x2 de molaire fractie van het oplosmiddel is. Als we beide zijden van de vergelijking vermenigvuldigen met P °, blijft het:
(3)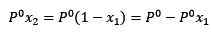
Resters vervangen (1) in (3):
(4)
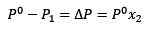
Dit is de variatie van de stoomdruk wanneer een opgeloste stof oplost.
Gravimetrische analyse
Gravimetrische analyse is een klasse van laboratoriumtechnieken die worden gebruikt om de massa of concentratie van een stof te bepalen door een verandering in massa te meten.
De chemicus die we proberen te kwantificeren wordt soms analyt genoemd. We zouden de gravimetrische analyse kunnen gebruiken om vragen te beantwoorden als:
Kan u van dienst zijn: metalen mineralen- Wat is de concentratie van de analyt in een oplossing?
- Hoe puur is ons monster? Het monster hier kan een vaste of oplossing zijn.
Er zijn twee veel voorkomende soorten gravimetrische analyse. Beide omvatten de verandering van de analytfase om deze te scheiden van de rest van een mengsel, wat aanleiding geeft tot een verandering in het deeg.
Een van deze methoden is neerslaggravimetrie, maar degene die ons echt interesseert, is vervluchtiging van gravimetrie.
Vervlantilisatiegravimetrie is gebaseerd op thermisch of chemisch het monster en meten de resulterende verandering in de massa.
Als alternatief kunnen we een vluchtig product van ontleding vangen en wegen. Omdat de afgifte van een vluchtige soort een essentieel onderdeel van deze methoden is, classificeren we ze collectief als Gravimetric Volatilisation Analysis -methoden.
Gravimetrische analyseproblemen zijn gewoon stoichiometrieproblemen met een paar extra stappen.
Om elke stoichiometrische berekening uit te voeren, hebben we de coëfficiënten van de gebalanceerde chemische vergelijking nodig.
Als een monster bijvoorbeeld onzuiverheden van dihydrated barium bevat (BACL2● h₂o), u kunt de hoeveelheid onzuiverheden krijgen die het monster verwarmen om het water te verdampen.
Het massaverschil tussen het oorspronkelijke monster en het verwarmde monster geeft ons in gram de hoeveelheid water in het bariumchloride.
Met een eenvoudige stoichiometrische berekening zal de hoeveelheid onzuiverheden van het monster worden verkregen.
Gefractioneerde destillatie
Fractionele destillatie is een proces waardoor de componenten van een vloeistofmengsel worden gescheiden in verschillende delen (fracties genoemd) volgens hun verschillende kookpunten.
Het volatiliteitsverschil van de verbindingen van het mengsel speelt een fundamentele rol in zijn scheiding.
Kan u van dienst zijn: octetregelFractionele destillatie wordt gebruikt om chemicaliën te zuiveren en ook om mengsels te scheiden en hun componenten te verkrijgen. Het wordt gebruikt als een laboratoriumtechniek en in de industrie, waar het proces groot commercieel belang heeft.
De dampen van een kokende oplossing worden doorgegeven langs een hoge kolom, onderzochte onderverdelingskolom.
De kolom is verpakt met plastic of glazen parels om de scheiding te verbeteren, waardoor er meer oppervlakte is voor condensatie en verdamping.
De kolomtemperatuur daalt geleidelijk langs de lengte. De componenten met een hoger kookpunt zijn gecondenseerd in de kolom en keren terug naar de oplossing.
De componenten met een lagere kookpunten (meer vluchtig) gaan door de kolom en worden bij de bovenkant verzameld.
Theoretisch verbetert het hebben van meer parels of platen de scheiding, maar de toevoeging van platen verhoogt ook de tijd en energie die nodig is om een destillatie te voltooien.
Vervlucht voorbeelden
- Een blok droog ijs in contact met een luchtuitbarsting. De lucht begint het vervluchtigingsproces en het ijs verdampt: het gaat van de vaste toestand naar de frisdrank.
- Wanneer water of andere stof wordt gekookt: warmte genereert stoom en dus gaat er water van de vloeibare toestand naar de gasvorming.
- De naftalinepillen, die geleidelijk afbreken en van de vaste toestand naar de frisdrank gaan.
- Wanneer vaste zwavel wordt onderworpen aan hoge temperaturen, wordt het giftige gassen. Dat wil zeggen, het gaat van vast tot gasvormig.
- Aromatiserende pillen: ze hebben hetzelfde proces als naftalinepillen, degraderen en worden geleidelijk gas, geurig en onschadelijk.
Referenties
- Drukdefinitie Steam. Hersteld van ThoughtCo.com.
- Dampdruk. Hersteld uit Britannica.com.

