Tolueenstructuur, eigenschappen, gebruik, verkrijgen
- 2934
- 378
- Ernesto McKenzie
Hij Tolueen Het is een aromatische koolwaterstof waarvan de gecondenseerde formule c is6H5Ch3 of phch3 En dat bestaat uit een methylgroep (CH3) Samen met een benzenische ring of fenylgroep (pH). Het wordt natuurlijk aangetroffen in ruwe olie, in kolen, in vulkanische emanaties en in sommige bomen, zoals de Tolú de América in het zuiden.
Dit karakteristieke geuroplosmiddel wordt voornamelijk gebruikt als een industriële grondstof, en als een verfverdunningsmiddel. Het wordt ook gebruikt bij de eliminatie van parasieten die aanwezig zijn bij katten en honden, zoals ascariden en AnyLostomes.
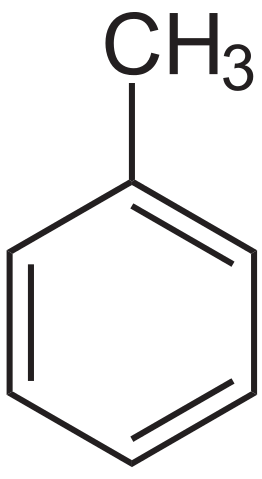
 Tolueen structurele formule. Bron: Neurotoger via Wikipedia.
Tolueen structurele formule. Bron: Neurotoger via Wikipedia. De tolueen werd voor het eerst geïsoleerd door Pierre-Joseph Pelletier en Philippe Walter, in 1837, van dennenolie. Vervolgens geïsoleerd Henri Etienne Sainte-Claire Deville, in 1841, het uit de Tolú-balsem en wees erop dat het product vergelijkbaar was met de eerder geïsoleerde. In 1843 doopte Berzelius hem als toluin.
Het grootste deel van tolueen wordt verkregen als een lateraal of secundair product in gasproductieprocessen en kolenconversie naar cola. Het wordt ook geproduceerd door reacties in het laboratorium, bijvoorbeeld de benzeenreactie met het methylchloride.
[TOC]
Structuur
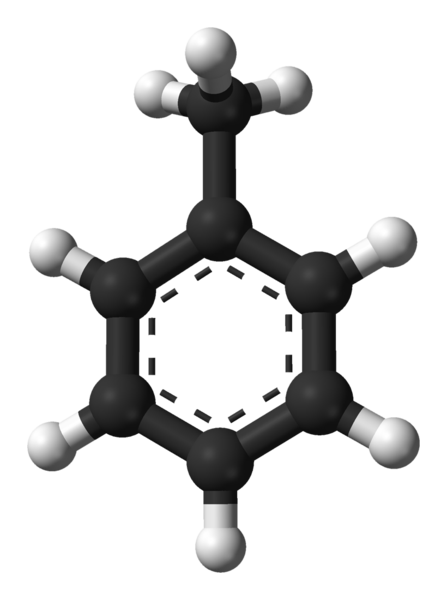 Moleculaire structuur van tolueen. Bron: Ben Mills via Wikipedia.
Moleculaire structuur van tolueen. Bron: Ben Mills via Wikipedia. In het superieure beeld hebben we de moleculaire structuur van de tolueen die wordt weergegeven door een model van bollen en balken. Merk op dat het er exact hetzelfde uitziet als de structurele formule aangegeven, met het verschil dat het geen plat molecuul is.
In het midden van de benzeenring, die in dit geval kan worden gezien als een fenylgroep, pH, wordt het aromatische karakter gemarkeerd door de stippellijnen. Alle koolstofatomen hebben SP -hybridisatie2, Behalve de CHO -groep3, wiens hybridisatie SP is3.
Het is om deze reden dat het molecuul niet volledig plat is: Cho -hydrogenen3 Ze bevinden zich onder verschillende hoeken van het benzenische ringvlak.
Kan u van dienst zijn: ionisatieconstanteTolueen is een apolair, hydrofoob en aromatisch molecuul. De intermoleculaire interacties zijn gebaseerd op de dispersieve krachten van Londen en in dipolo-dipolo-interacties, omdat het centrum van de ring wordt "geladen" van elektronische dichtheid die door de CH wordt geleverd3; Terwijl waterstofatomen een lage elektronische dichtheid hebben.
Daarom heeft tolueen verschillende soorten intermoleculaire interacties die de moleculen van hun vloeibare samenhangende houden. Dit wordt weerspiegeld in zijn kookpunt, 111 ° C, wat hoog is, gezien het feit dat het een apolair oplosmiddel is.
Eigenschappen
Fysiek uiterlijk
Kleurloze en transparante vloeistof
Molaire massa
92,141 g/mol
Geur
Sweet, Acre en vergelijkbaar met die van benzeen
Dikte
0,87 g/ml bij 20 ºC
Smeltpunt
-95 ºC
Kookpunt
111 ºC
Oplosbaarheid
Tolueen heeft een verachtelijke oplosbaarheid in water: 0,52 g/l bij 20 ° C. Dit vanwege het verschil in polariteiten tussen tolueen en water.
Aan de andere kant is tolueen oplosbaar, of in dit geval mengbaar, met ethanol, benzeen, ethylether, aceton, chloroform, ijsazijn en koolstofdisulfide; dat wil zeggen, het is beter opgelost in minder polaire oplosmiddelen.
Brekingsindex (nD))
1.497
Smurrie
0,590 CP (20 ºC)
ontstekingspunt
6 ºC. Tolueen moet worden gemanipuleerd in het extrahale kampen van gas en zo ver mogelijk weg van elke vlam.
Dampdichtheid
3.14 in luchtrelatie = 1. Dat wil zeggen, hun dampen zijn drie keer dichter dan de lucht.
Dampdruk
2.8 kPa bij 20 ° C (ongeveer 0.27 ATM).
Zelf -uitsluittemperatuur
480 ° C
Ontleding
Kan krachtig reageren op oxiderende materialen. Wanneer hij tot ontleding wordt verwarmd, straalt hij een hectare en irritante rook uit.
Oppervlaktespanning
29,46 mn bij 10 ºC
Dipolair moment
0,36 D
Reactiviteit
Tolueen is vatbaar voor chlorering om ortho-chlorotolueen en para-clorotolueen te produceren. Het is ook gemakkelijk te nitrificeren om nitrotolueen te produceren, wat de grondstof van de kleurstoffen is.
Kan u van dienst zijn: atoomgewichtEen deel van tolueen wordt gecombineerd met drie delen van salpeterzuur om trinitrotolueen (TNT) te veroorzaken: een van de bekendste explosieven.
Evenzo ervaart tolueen sulfonatie om o-toluen-sulfonische en p-toluen-sulfonzuren te genereren, die de grondstof zijn voor de vervaardiging van kleurstoffen en saccharine.
De tolueenmethylgroep ervaart verlies van waterstof door de werking van een sterke basis. De methylgroep is ook vatbaar voor oxidatie, dus het reageert met kaliumpermanganaat om benzoïne- en benzaldehydezuur te veroorzaken.
Toepassingen
Industriëlen
 De TNT, de meest symbolische explosieven van allemaal, komt voor door de tolueen als het belangrijkste grondstof. Bron: Pixabay.
De TNT, de meest symbolische explosieven van allemaal, komt voor door de tolueen als het belangrijkste grondstof. Bron: Pixabay. Tolueen wordt gebruikt bij de uitwerking van schilderijen, verdunningen van verf, nagelpolijst, lijmen of tandvlees van pasta, lakken, inkten, nylon, plastic, polyurethaanschuim, de meeste oliën, vinylorganen, medicijnen, kleurstoffen, kleurstoffen, parfums, explosieven (tnt).
Op dezelfde manier wordt tolueen gebruikt in de vorm van toluenosulfonados bij de productie van wasmiddel. Tolueen is ook van groot belang bij de vervaardiging van plastic cement, cosmetische kleuring, antivries, inkten, asfalt, permanente markers, contactcement, enz.
Oplosmiddel en verdunningsmiddel
Tolueen wordt gebruikt bij de verdunning van de schilderijen, die de toepassing ervan vergemakkelijkt. Het wordt gebruikt om de randen van de polystyreenkits op te lossen, waardoor de unie van de onderdelen die modellen van schaalvliegtuigen vormen, mogelijk. Bovendien wordt het gebruikt bij de extractie van natuurlijke producten uit planten.
Tolueen is een inktoplosmiddel dat in het gegraveerde gat wordt gebruikt. Cements gemengd met rubber en tolueen worden gebruikt om een groot aantal producten te bedekken. Evenzo wordt tolueen gebruikt als een oplosmiddel in gedrukte inkten, lakken, lederen leerlooiers, lijm en desinfectiemiddelen.
Kan je van dienst zijn: molair absorberenEn nog interessanter, tolueen wordt gebruikt als een oplosmiddel van koolstofnanomaterialen (zoals nanobuisjes) en fullerenos.
Anderen
Een mengsel van benzeen, tolueen en xyleen (BTX) wordt toegevoegd aan benzine om het octaan te vergroten. Toluene is een additief van vliegtuiggas en een hoog octaanreserve. Het wordt ook gebruikt bij de uitwerking van NAFTA.
Tolueen helpt bij de eliminatie van sommige soorten ascárides en anquilostomos, evenals teni die parasieten zijn van katten en honden.
Het verkrijgen van
Het grootste deel van het tolueen wordt verkregen uit gedestilleerde producten van ruwe olie, gegenereerd tijdens koolwaterstofpyrolyse (stoomscheuren). De katalytische hervorming van oliedampen vertegenwoordigt 87 % van de geproduceerde tolueen.
Extra 9 % van tolueen uit pyrolyse benzine geproduceerd tijdens de productie van ethyleen en propyleen.
Hulla -teer van cola -ovens draagt 1 % bij van de geproduceerde tolueen, terwijl de resterende 2 % wordt verkregen als een bijproduct van de productie van het stuk.
Schadelijke effecten
Tolueen is een oplosmiddel dat wordt ingeademd om high te worden, omdat het een verdovende actie heeft die het werking van het centrale zenuwstelsel beïnvloedt. Tolueen komt het lichaam binnen voor inname, inademing en absorptie door de huid.
Op een blootstellingsniveau van 200 ppm, excitatie, euforie, hallucinaties, vervormde percepties, hoofdpijn en duizeligheid kunnen optreden. Hoewel hogere niveaus van blootstelling aan tolueen depressie kunnen veroorzaken, slaperigheid en stupor.
Wanneer inademing een concentratie van 10 overschrijdt.000 ppm, is in staat om de dood van het individu te produceren als gevolg van ademhalingsfalen.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Nationaal centrum voor biotechnologie -informatie. (2020). Tolueen. PubChem -database., CID = 1140. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2020). Tolueen. Opgehaald uit: in.Wikipedia.borg
- Engineering Toolbox, (2018). Tolueen - Thermofysische eigenschappen. [Online] hersteld van: engineeringtoolbox.com
- Vedantu. (S.F.)). Tolueen. Hersteld van: Vedantu.com
- « Destructieve interferentieformule en vergelijkingen, voorbeelden, oefening
- Polyvinylpirrolidonstructuur, eigenschappen, gebruik, bijwerkingen »

