Tyrosine -kenmerken, structuur, functies, voordelen
- 2728
- 224
- Ernesto McKenzie
De Tyrosine (Tyr, Y) is een van de 22 aminozuren die de eiwitten vormen van alle cellen die aanwezig zijn in levende wezens. In tegenstelling tot andere aminozuren zoals valine, treonine, tryptofaan, leucine, lysine en anderen, is tyrosine een "voorwaardelijk" in wezen essentieel aminozuur.
De naam "tyrosine" komt voort uit het Griekse woord "schieten", wat kaas betekent, omdat dit aminozuur voor het eerst werd ontdekt in dit voedsel. De term werd bedacht in 1846 door Liebig, die kaas gemengde met kaliumhydroxide en een onbekende verbinding verkregen, nauwelijks oplosbaar in water.
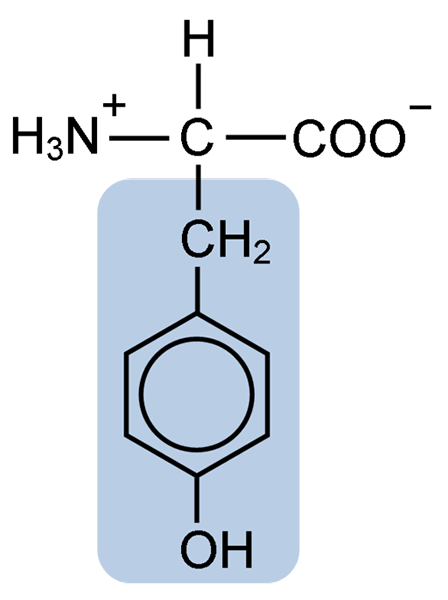
 Chemische structuur van het tyrosine-aminozuur (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons)
Chemische structuur van het tyrosine-aminozuur (Bron: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] via Wikimedia Commons) Na de eerste beschrijving, andere onderzoekers zoals Warren de la Rue en Hinterberger verkregen uit respectievelijk kokoidinsecten en hoorns -eiwitten. De scheiding van de hydrolyse van andere eiwitten met zoutzuur werd in 1901 beschreven door Mörner.
Over het algemeen wordt dit aminozuur verkregen bij zoogdieren dankzij de hydroxylering van fenylalanine, hoewel het ook wordt geabsorbeerd in de darm van de eiwitten die worden geconsumeerd met voedsel.
Tyrosine heeft meerdere functies in het menselijk lichaam en onder deze de meest relevante zijn misschien dat van substraat voor de productie van neurotransmitters en hormonen zoals adrenaline en schildklierhormoon.
[TOC]
Kenmerken
Tyrosine weegt ongeveer 180 g/mol en de R- of zijketengroep heeft een 10 -dissociatieconstante 10.07. De relatieve overvloed ervan in celeiwitten is niet groter dan 4%, maar heeft meerdere essentiële functies voor de menselijke fysiologie.
Dit aminozuur behoort tot de groep aromatische aminozuren, waarbij fenylalanine en tryptofaan ook zijn. De leden van deze groep hebben aromatische ringen in hun r r- of zijketens en meestal zijn het hydrofobe of apolaire aminozuren.
Net als tryptofaan absorbeert tyrosine ultraviolet licht en is een van het aminozuurafval dat verantwoordelijk is voor de absorptie van licht tot 280 nm van veel eiwitten, dus het is nuttig voor de karakterisering.
Het wordt beschouwd als een essentieel "voorwaardelijk" aminozuur, omdat de biosynthese ervan in de mens afhankelijk is van fenylalanine, een essentieel aminozuur. Als het lichaam voldoet aan zijn dagelijkse vereisten van fenylalanine, kan tyrosine zonder probleem worden gesynthetiseerd en is het geen beperkend aminozuur.
Als het dieet echter ontbreekt aan fenylalanine, heeft het lichaam niet alleen een onbalans van dit aminozuur, maar ook van tyrosine. Het is ook belangrijk om erop te wijzen dat de reactie van tyrosinesynthese van fenylalanine niet omkeerbaar is, dus kan de tyrosine niet voldoen aan de cellulaire behoeften van fenylalanine.
Tyrosine behoort ook tot de aminozuurgroep met dubbele functies bij de productie van glucogene en ketogene metabole intermediairs, die deelnemen aan de synthese van glucose voor de hersenen en bij de vorming van ketonlichamen in de lever.
Structuur
Net als de rest van de aminozuren, het tyrosine, of het β-parahydroxyfenyl-a-amino-propionzuur, is het een a-aminozuur dat een centraal koolstofatoom heeft, koolstof α genoemd en dat chiraal is, omdat het is gekoppeld aan het chirale Vier verschillende substituentatomen of moleculen.
Deze quirale koolstof is gekoppeld aan twee karakteristieke groepen aminozuren: een aminogroep (NH2) en een carboxylgroep (COOH). Hij deelt ook een van zijn obligaties met een waterstofatoom en de resterende binding wordt bezet door de R of zijketen van elk aminozuur.
In het geval van tyrosine bestaat deze groep uit een aromatische ring geassocieerd met een hydroxyl (OH) -groep, waardoor het vermogen wordt om waterstofbruggen te vormen met andere moleculen en dat het essentiële functionele kenmerken voor bepaalde enzymen geeft.
Het kan u van dienst zijn: baroreceptorenFunctie
Tyrosine is een fundamenteel onderdeel van veel eiwitten met een grote diversiteit aan biologische activiteiten en functies.
Bij mensen en andere zoogdieren wordt dit aminozuur gebruik gemaakt in zenuw- en nierweefsels voor de synthese van dopamine, adrenaline en norepinefrine, drie neurotransmitters gerelateerde catecholaminerge gerelateerde catecholaminergics die betrekking hebben op het grootste belang voor lichaamsfunctioneren.
Het is ook essentieel voor de synthese van ultraviolette stralingsbeschermers (UV) zoals melanine; van sommige analgetica zoals endorfines en antioxidantmoleculen zoals vitamine E.
Evenzo dient dit aminozuur voor de synthese van tiramine, octopamine en schildklierhormonen via jodiumorganisatie in het tyrosineresten van thyoglobuline.
Tiramine is een vasoactief molecuul dat in het menselijk lichaam wordt gevonden en octopamine is een amine gerelateerd aan noreprenaline.
Al deze functies van tyrosine zijn mogelijk dankzij het verkrijgen van de eiwitten van het dieet of door hydroxylering van fenylalanine met de lever als het hoofdsysteem van systemische toevoer van genoemd aminozuur.
Functies in planten
Tyrosine en enkele van de tussenpersonen die tijdens hun biosynthese zijn gegenereerd, voeden de biosynthetische routes van metabolieten gespecialiseerd in verdediging, in de aantrekkingskracht van bestuivers, in elektronisch transport en structurele ondersteuning.
Biosynthese
In de mens wordt tyrosine verkregen uit het dieet of gesynthetiseerd in een enkele stap door levercellen uit fenylalanine, een essentieel aminozuur, door de reactie gekatalyseerd door het fenylalaninehydroxylase -enzymatisch complex.
Dit complex heeft zuurstofactiviteit en is alleen aanwezig in de lever van mensen of andere zoogdieren. Tyrosine -synthese -reactie impliceert dan de overdracht van een zuurstofatoom naar de positie voor van de aromatische ring van fenylalanine.
Deze reactie treedt tegelijkertijd op dat een watermolecuul wordt gevormd door de reductie van een ander moleculair zuurstofatoom en het reductievermogen wordt direct bijgedragen door een NADPH geconjugeerd met een tetrahydropterine -molecuul, dat vergelijkbaar is met foliumzuur.
Biosynthese in planten
In planten wordt tyrosine gesynthetiseerd van novo stroomafwaarts van de "Shikimato" -route, die andere biosynthetische routes van andere aromatische aminozuren zoals fenylalanine en tryptofaan voedt.
In deze organismen is de synthese gebaseerd op een verbinding die bekend staat als "Corismato", het eindproduct van de Shikimato -route en bovendien de gemeenschappelijke voorloper voor alle aromatische aminozuren, bepaalde vitamines en plantenhormonen.
De corismate wordt omgezet in het voorwoord door de katalytische werking van het mutasa -corismaat -enzym en dit is de eerste "toegewijde" stap in de synthese van tyrosine en fenylalanine in planten.
Het proedeaat wordt omgezet in tyrosine door een oxidatieve decarboxylering en een transaminatie, die in elke volgorde kan optreden.
In een van de biosynthetische routes kunnen deze stappen worden gekatalyseerd door specifieke enzymen die bekend staan als prefenaatspecifieke dehydrogenase (PDH) (die het voorwoord omzet in 4-hydroxyfenylpyphenylpyruvaat (HPP)) en tyrosine aminotransferase (die de tyro's van het hpp) van de hpp) van het hpp) respectievelijk.
Een ander pad van synthese van tyrosine uit het voorwoord impliceert de transaminatie van het proedeaat naar een niet-eiwinogeen aminozuur genaamd L-arogenaat, gekatalyseerd door het enzym Preenate Aminotransferase.
Het L-arogenaat is vervolgens onderworpen aan oxidatieve decarboxylering om thyroxine te vormen, een reactie gericht door een enzym tyrosine-arogenaat-specifieke dehydrogenase, ook bekend als ADH.
Planten gebruiken bij voorkeur de route van het arenaat, terwijl de meeste microben tyrosine synthetiseren uit de HPP afgeleid van de predenesaat.
Regulatie
Zoals geldt voor de meeste biosynthetische routes van aminozuren, hebben planten een strikt systeem van regulatie van de synthese van aromatische aminozuren, waaronder tyrosine.
Kan u van dienst zijn: heerlijk monster: kenmerken, habitat, zorg, eigenschappenIn deze organismen treedt regulering op vele niveaus op, omdat de mechanismen die de Shikimato -route regelen ook de productie van tyrosine regelen, een route waarvoor er ook hun eigen regulatiemechanismen zijn.
Tyrosinevereisten en daarom zijn de stijfheid bij de regulering van hun biosynthese echter specifiek voor elke plantensoort.
Degradatie
De afbraak of katabolisme van tyrosine resulteert in de vorming van fumaraat en acetoacetaat. De eerste stap van deze route bestaat uit de omzetting van het aminozuur in 4-hydroxyfenylpypypaat door een cytosolisch enzym dat bekend staat als aminotransferase tyrosine.
Dit aminozuur kan ook worden getransamineerd in de mitochondria van hepatocyten door een aminotransferase -aspartaat -enzym, hoewel dit enzym niet erg belangrijk is in normale fysiologische omstandigheden.
Door de afbraak van tyrosine kan succinyl-acetoacetaat optreden, die kan worden gedecarboxyleerd tot succinyl-acetaat. Succinyl-acetaat is de krachtigste enzymremmer die verantwoordelijk is voor de synthese van de hemo-groep, het 5-aminolevulinezuurdehydratase.
Adrenaline en norepinefrine synthese
Zoals vermeld, is tyrosine een van de belangrijkste substraten voor de synthese van twee zeer belangrijke neurotransmitters voor het menselijk lichaam: adrenaline en norepinefrine.
Dit wordt aanvankelijk gebruikt door een enzym dat bekend staat als de hydroxylase tyrosine, in staat om een extra hydroxylgroep toe te voegen aan de aromatische ring van de Ri tyrosine R -groep, die de verbinding vormt die bekend staat als DOPA.
De DOPA geeft aanleiding tot dopamine zodra het enzymatisch is verwerkt door een enzym dopa decboxilas.
Dopamine wordt vervolgens omgezet in noreprenaline door de werking van het β -oxidase -dopamine -enzym, dat de toevoeging van een hydroxylgroep aan -CH katalyseert die deel uitmaakte van de groep R van de tyrosine en die werkte als een "brug" tussen de aromatische ring en koolstof α.
Adrenaline is afgeleid van norepinefrine door de werking van fenythanolamine N-methyltransferase, dat verantwoordelijk is voor de S-adenosyl-metionine-afhankelijke overdracht van een methylgroep (-CH3) naar de vrije aminogroep van norepinefrine.
Voedsel rijk aan tyrosine
Zoals hierboven vermeld, is tyrosine een essentieel "voorwaardelijk" aminozuur, omdat het in het menselijk lichaam wordt gesynthetiseerd door hydroxylering van fenylalanine, een essentieel aminozuur.
Daarom, als de inname van fenylalanine de eisen van het lichaam bedekt, is tyrosine geen beperkende factor voor het normale functioneren van cellen. Tyrosine wordt echter ook verkregen van eiwitten die worden geconsumeerd met dagelijkse voedingsmiddelen.
Sommige studies melden dat de minimale dagelijkse inname van zowel tyrosine als fenylalanine tussen 25 en 30 mg per kilogram gewicht moet zijn, dus een gemiddeld persoon moet min of meer 875 mg tyrosine per dag consumeren.
Voedingsmiddelen met een hoger tyrosinegehalte zijn kaas en sojabonen. Onder deze zijn ook rundvlees, lam, varkensvlees, kip en vis.
Sommige zaden en noten zoals noten leveren ook belangrijke bijdragen van dit aminozuur, evenals eieren, zuivelproducten, granen en granen.
Voordelen van uw inname
Tyrosine wordt vaak geconsumeerd in de vorm van voedings- of voedingssupplementen, met name voor de behandeling van pathologie die bekend staat als fenylcetonurie, geleden door patiënten die niet in staat zijn fenylalanine goed te verwerken en produceren daarom geen tyrosine.
Het kan u van dienst zijn: RelatiefunctieEr wordt gedacht dat een toename van de hoeveelheid tyrosine die per dag wordt geconsumeerd, cognitieve functies kan verbeteren die verband houden met leren, geheugen en alert toestand in stressvolle omstandigheden, omdat het katabolisme gerelateerd is aan de synthese van adrenaline en noredelie -neurotransmitters.
Sommige mensen nemen tirosine -rijke tabletten om overdag alert te blijven als ze een aanzienlijke hoeveelheid slaapuren hebben verloren.
Aangezien dit aminozuur deelneemt aan de vorming van schildklierhormoon, kan het verbruik ervan positieve effecten hebben op systemische metabole regulatie.
Deficiëntiestoornissen
Albinisme en alcaptonurie zijn twee pathologieën gerelateerd aan tyrosinemetabolisme. De eerste voorwaarde is gerelateerd aan defecte melaninesynthese uit tyrosine en de tweede heeft te maken met defecten in degradatie van tyrosine.
Albinisme wordt gekenmerkt door het gebrek aan pigmentatie in de huid, dat wil zeggen dat de patiënten die er last van hebben, wit haar en rozehuid hebben, omdat melanine het pigment is dat verantwoordelijk is voor het geven van kleur aan deze structuren.
Deze pathologie heeft te maken met een tekort aan het specifieke tyrosinase van melanocyten, dat verantwoordelijk is voor het omzetten van tyrosine in dopa-quinon, een tussenpersoon in de synthese van melanine.
De symptomen van alcaptonurie zijn duidelijk als een overdreven urinepigmentatie (donker) en late ontwikkelingsartritis.
Andere metabole pathologieën
Bovendien zijn er andere aandoeningen gerelateerd aan het tyrosinemetabolisme, waaronder:
- Erfelijke tyrosinemie van Type I: Gekenmerkt door progressieve lever degeneratie en nierdisfunctie
- Erfelijke tyrosinemie van Type II of Richner-Hanhart-syndroom: wat duidelijk is als een keratitis en ampulaire laesies in de handpalmen enzolen van de voeten
- Type III tyrosinemie: die asymptomatisch kan zijn of aanwezig kan zijn als mentale vertragingen
- "Hawkinsinuria": gekenmerkt door metabole acidose in de kindertijd en het onvermogen om te bloeien in groei
Er zijn ook andere aangeboren defecten in het metabolisme van het metrosinemetabolisme die te maken hebben met tekortkomingen in de enzymen die verantwoordelijk zijn voor hun afbraak, zoals hydroxylase tyrosine, belast met de eerste stap van de synthese van dopamine uit tyrosine uit tyrosine.
Referenties
- Aders Plimmer, r. (1908). De chemische samenstelling van de eiwitten. Ik ben weggegaan. Londen, VK: Longmans, Green en Co.
- Chakrapani, a., Gissen, p., & McKiernan, P. (2012). Stoornissen van tyrosinemetabolisme. In Aangeboren metabolische wens: diagnose en behandeling (PP. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, h. (1956). Bepaalde aspecten van het tyrosinemetabolisme bij jongeren. Je. De ontwikkeling van het tyrosine -oxiderende systeem in menselijke lever. The Journal of Clinical Investigation, 35(10), 1089-1093.
- Du, b., Zannoni, V., Laster, l., & Seegmiller, E. (1958). De aard van het defect in het tyrosinemetabolisme in Alkaptonuria. Journal of Biological Chemistry, 230, 251-260.
- Murray, r., Bender, D., Botham, k., Kennelly, p., Rodwell, V., & Weil, p. (2009). Harper's geïllustreerde biochemie (28e ed.)). McGraw-Hill Medical.
- Nelson, D. L., & Cox, m. M. (2009). Lehninger -principes van biochemie. Omega -edities (5e ed.)).
- Schenck, c. NAAR., & Maeda, h. NAAR. (2018). Tyrosinebiosynthese, metabolisme en katabolisme in planten. Fytochemie, 149, 82-102.
- Slominski, een., Zmijewski, m. NAAR., & Paweleley, J. (2012). L-tyrosine en L-dihydroxyfenylalanine als hormoonachtige regulatoren van melanocytenfuncties. Pigmentcel- en melanoomonderzoek, 25(1), 14-27.
- Van de, g. (2018). Gezondheidslijn. Ontvangen op 16 september 2019, van www.Gezondheidslijn.com
- MD Web. (N.D.)). Ontvangen op 15 september 2019, van www.Webmd.com
- Whitbread, D. (2019). Mijn voedselgegevens. Ontvangen op 15 september 2019, van www.Myfooddata.com

