Soorten batterijen, kenmerken en reacties

- 2530
- 343
- Ernesto McKenzie
In de markt kunt u anders worden Soorten batterijen met Haar caracteristieken eigen. De batterijen, die niets meer zijn dan voltaïsche cellen, bieden de consument het voordeel van het nemen van een plaats (op voorwaarde dat de omstandigheden niet drastisch zijn).
Over het algemeen kunnen batterijen geïsoleerd worden gekocht; Maar ze zijn ook aan elkaar bevestigd in serie of parallel, wiens set is wat ze batterijen noemen. En dus worden de termen 'batterijen' en 'batterijen' meestal meestal zonder onderscheid gebruikt, zelfs als ze niet hetzelfde zijn.
 Alkalische batterijen: een van de bekendste soorten batterijen
Alkalische batterijen: een van de bekendste soorten batterijen De batterijen kunnen ontelbare kleuren, vormen en maten hebben, zoals kan worden gemaakt van andere materialen. Ook, en nog belangrijker, hun interne structuur, waar chemische reacties die elektriciteit genereren, worden ontwikkeld, dient om ze van elkaar te onderscheiden.
Bijvoorbeeld, drie alkalische batterijen, een van de meest voorkomende worden weergegeven in de bovenste afbeelding. De term alkalische verwijst naar het feit dat het medium waar de afgifte en stroom van elektronen zich voordoet, basic is; dat wil zeggen, het heeft een pH groter dan 7 en de oh anionen overheersen- en andere negatieve ladingen.
[TOC]
PILAS -classificatie
Voordat u enkele van de verschillende soorten batterijen aanpakt, is het noodzakelijk om te weten dat deze wereldwijd als primair of secundair zijn geclassificeerd.
- Primaire batterijen
Primaire batterijen zijn die die eenmaal consumeerden, moeten worden weggegooid of gerecycled, omdat de chemische reactie waarop de elektrische stroom wordt gehandhaafd onomkeerbaar is. Daarom kunnen deze niet worden opgeladen.
Ze worden voornamelijk gebruikt in toepassingen waar het onpraktisch is om elektrische energie op te laden; zoals op militaire apparaten, midden in het slagveld. Ze zijn ook ontworpen voor apparatuur die weinig energie verbruikt, zodat ze langer meegaan; Bijvoorbeeld afstandsbedieningen of draagbare consoles (Gameboy, Tetris en Tamagotchi).
Alkalische batterijen, om een ander voorbeeld te citeren, behoren ook tot het primaire type. Ze hebben meestal cilindrische vormen, hoewel dit niet betekent dat cilindrische batterijen niet secundair of oplaadbaar kunnen zijn.
- Secundaire batterijen
In tegenstelling tot primaire batterijen kunnen secundaire worden opgeladen zodra ze geen energie meer hebben.
Dit komt omdat de chemische reacties die erin optreden omkeerbaar zijn en daarom, na het toepassen van een bepaalde spanning, ervoor zorgt dat de productsoort weer reagens wordt, om de reactie opnieuw te beginnen.
Sommige secundaire batterijen (batterijen genoemd) zijn meestal klein, net als primair; Ze worden echter toegewezen aan apparaten die meer energie verbruiken en waarvoor het gebruik van primaire batterijen economisch en energiek zou zijn. Batterijen van mobiele telefoons bevatten bijvoorbeeld secundaire batterijen.
Ook zijn secundaire batterijen ontworpen voor grote apparatuur of circuits; Bijvoorbeeld autobatterijen, die zijn samengesteld uit verschillende batterijen of voltaische cellen.
Ze zijn meestal duurder dan primaire batterijen en batterijen, maar voor langetermijngebruik worden ze uiteindelijk een geschiktere en effectievere optie.
- Andere aspecten
De batterijen zijn geclassificeerd in primair of secundair; Maar commercieel of in de volksmond worden ze meestal geclassificeerd volgens de vorm (cilindrische, rechthoekige, knoppen), naar het apparaat bestemd (camera's, voertuigen, rekenmachines), naar hun namen (AA, AAA, C, D, N, A23, enz .), En aan zijn IEC- en ANSI -codes.
Het kan u van dienst zijn: pyridine: structuur, eigenschappen, gebruik, toxiciteit, syntheseOok zijn kenmerken zoals de spanning (1,2 tot 12 volt), evenals hun nuttige levensduur en prijzen, verantwoordelijk voor het verlenen van een bepaalde classificatie in de ogen van de consument.
Paaltypenlijst
- Koolstofzinkbatterijen
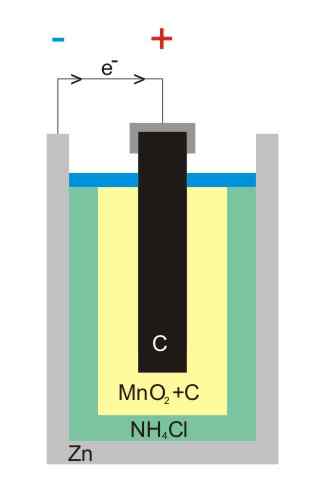 Zink-koolstofbatterij Illustratie
Zink-koolstofbatterij Illustratie Koolstofzinkbatterijen (ook bekend als Leclanché of Salinas Pilas-cellen) zijn een van de meest primitieve en worden momenteel als bijna niet gebruikt voor andere batterijen beschouwd; Vooral, voor de alkalische batterijen, die hoewel ze een beetje duurder zijn, hebben ze een levensduur en grote spanningen.
Zoals de naam al aangeeft, bestaan de elektroden ervan uit een blik zink en een grafietstang, respectievelijk overeenkomend met de anode en kathode.
In de eerste elektrode ontstaat de anode de elektronen door oxidatie van het metallic zink. Deze elektronen reizen vervolgens op een extern circuit dat het apparaat met elektriciteit voedt en eindigt vervolgens in de grafietkathode, waarbij de cyclus wordt voltooid wanneer het mangaandioxide wordt verminderd waarin het is ondergedompeld.
Reacties
De chemische vergelijkingen voor de reacties die optreden in de elektroden zijn:
Zn (s) → Zn2+(AC) + 2e- (Anode)
2 MNO2(s) + 2e- + 2 NH4CL (AC) → Mn2OF3(S) + 2 NH3(AC) + H2Of (l) + 2 Cl- (AC) (kathode)
Deze batterijen lijken erg op de alkalische: beide zijn cilindrisch (zoals die van de afbeelding). Koolstofzinkbatterijen kunnen echter worden onderscheiden als de in het buitenland gelabelde kenmerken in detail worden gelezen, of als uw IEC-code wordt voorafgegaan door letter R. De spanning is 1,5 V.
- Alkalische batterijen
Alkalische batterijen lijken erg op die van het koolstofzinktype, met het verschil dat het medium waar de elektroden oh anionen bevatten-. Dit medium bestaat uit sterke elektrolyten van kaliumhydroxide, KOH, die de OH bijdraagt- die deelnemen en "samenwerken" bij de migratie van elektronen.
Het komt in verschillende maten en spanningen, hoewel de meest voorkomende 1,5 V is. Ze zijn misschien wel de bekendste batterijen op de markt (bijvoorbeeld Duracell).
De reacties die zich voordoen in hun elektroden zijn:
Zn (S) + 2OH-(aq) → zno (s) + h2Of (l) + 2e- (Anode)
2mn2(s) + h2Of (l) + 2e- → Mn2OF3(S) + 2OH-(aq) (kathode)
Naarmate de temperatuur toeneemt, treden de reacties sneller op en worden de batterijen ontladen. Interessant is dat populaire geruchten werden uitgevoerd om hen in de vriezer te plaatsen om hun woontijd te vergroten; Maar bij het koelen kan de inhoud ervan mogelijke solidificaties lijden die verdere gebreken of risico's met zich meebrengen.
Kwik
 Waarschijnlijke kwikbatterij, die kan worden verward met de zilveroxide -batterij. Bron: Multicherry [CC0].
Waarschijnlijke kwikbatterij, die kan worden verward met de zilveroxide -batterij. Bron: Multicherry [CC0]. Kwikbatterijen zijn zeer kenmerkend vanwege hun bijzondere schaamte van zilveren knoppen (superieure afbeelding). Bijna iedereen zou ze op het eerste gezicht herkennen. Ze zijn ook alkalisch, maar hun kathode omvat, naast grafiet- en mangaandioxide, kwikoxide, HGO; Die na het verminderen van metalen kwik wordt:
Zn (S) + 2OH-(AC) → ZnO (S) + H2Of (l) + 2e-
HGO (S) + H2O + 2e- → Hg (s) + 2OH-
Kan u van dienst zijn: magnesiumoxide: structuur, eigenschappen, nomenclatuur, gebruikMerk op hoe in deze celreacties de OH -anionen worden geconsumeerd en geregenereerd-.
Als kleine batterijen, is het bedoeld voor kleine artefacten, zoals horloges, rekenmachines, speelgoedbedieningen, enz. Die een van deze objecten heeft gebruikt, zal hebben gemerkt dat het niet nodig is om de batterijen te veranderen voor bijna een "eeuwigheid"; die ongeveer 10 jaar oud zou zijn.
Zilveroxide
 Zilveroxidebatterijen. Bron: Lukas A, CZE [Public Domain].
Zilveroxidebatterijen. Bron: Lukas A, CZE [Public Domain]. Het belangrijkste defect van kwikbatterijen is dat wanneer ze worden weggegooid, ze een ernstig probleem vormen voor de omgeving, vanwege de giftige kenmerken van genoemde metaal. Misschien mist dit IEC- en ANSI -codes. Voor zilveroxidebatterijen wordt de IEC -code voorafgegaan door de letter S.
Een van de vervangers voor kwikbatterijen komt overeen met die van zilveroxide, veel duurder, maar van minder ecologische impact (superieur beeld). In het begin bevatten ze kwik om het zink te beschermen tegen alkalische corrosie.
Het is beschikbaar met een spanning van 1,5 V en de toepassingen zijn erg vergelijkbaar met die van de Mercury Pila. In het eerste gezicht zien beide batterijen er zelfs identiek uit; Hoewel er veel grotere zilveroxidebatterijen kunnen zijn.
De reacties in hun elektroden zijn:
Zn (S) + 2OH-(AC) → Zn (OH)2(s) + 2 e-
Ag2Of (s) + 2H+(AC) + 2e- → 2ag (s) + h2Of (l)
Water lijdt vervolgens aan elektrolyse, ontbindingen op H -ionen+ en oh-.
Merk op dat het in plaats van kwik wordt gevormd in de metalen zilverkathode.
- Nikkel-Cadmium Pilas (Nicad)
 NICD -batterij. Bron: Lordider [CC0].
NICD -batterij. Bron: Lordider [CC0]. Vanaf dit punt worden secundaire batterijen of batterijen overwogen. Net als kwik zijn nikkel-cadmiumbatterijen schadelijk voor het milieu (voor fauna en gezondheid) door cadmiummetaal.
Ze worden gekenmerkt door hoge elektrische stromen te genereren en een groot aantal keren kan worden opgeladen. In feite kan 2000 keer worden opgeladen, wat gelijk is aan buitengewone duurzaamheid.
De elektroden bestaan uit nikkeloxidehydroxide, kind (OH), voor de kathode en metallic cadmium voor de anode. De chemische basis blijft in wezen hetzelfde: cadmium (in plaats van zink) verliest elektronen en cadmium nio (oh) wint ze.
De semicelled reacties zijn:
CD (s) + 2OH-(AC) → CD (OH)2(s) + 2e-
2nio (oh) (s) + 2H2Of (l) + 2e- → 2ni (oh)2(s) + oh-(AC)
Oh anionen-, Nogmaals, ze komen van de Koh -elektrolyt. Nicad -batterijen genereren uiteindelijk nikkel- en cadmiummetaalhydroxiden.
Ze worden afzonderlijk gebruikt of gekoppeld aan pakketten (zoals gele, superieure afbeelding). Ze komen dan in grote of kleine pakketten. De kleintjes vinden gebruik in speelgoed; Maar de grote zijn bestemd voor vliegtuigen en elektrische voertuigen.
- Nikkel-Hydro Metallic Pilas (Ni-HM)
 Ni-HM-batterijen. Bron: Ramsh ng van flickr (https: // www.Flickr.com/foto's/rameshng/5645036051)
Ni-HM-batterijen. Bron: Ramsh ng van flickr (https: // www.Flickr.com/foto's/rameshng/5645036051) Een andere bekende batterij of batterij, en die de NICAD's in energcapaciteiten overschrijdt, is Ni-HM (nikkel en metaalhydride). Het kan in cilindrisch formaat komen (conventionele batterijen, superieure afbeelding) of gekoppeld in een batterij.
Chemisch vertoont bijna dezelfde kenmerken als Nicad -batterijen, met het belangrijkste verschil gebaseerd in zijn negatieve elektrode: de kathode is geen cadmium, maar van een intermetallische legering van zeldzame aardes en overgangsmetalen.
Kan u van dienst zijn: roterende droger: bediening, waarvoor is het voor, onderdelen, toepassingenDeze legering is verantwoordelijk voor het absorberen van waterstof gevormd tijdens de belasting, waardoor een complex metaalhydride wordt gegenereerd (vandaar de letter H in zijn naam).
Hoewel Ni-HM-batterijen meer energie bieden (ongeveer 40% meer), duurder zijn, dragen ze sneller en kunnen ze niet hetzelfde aantal keren opnieuw worden geladen als NICAD-batterijen; dat wil zeggen, ze hebben een lagere levensduur. Ze missen echter het geheugeneffect (verlies van batterijprestaties door niet volledig te worden ontslagen).
Het is om deze reden dat ze niet mogen worden gebruikt in machines die op de lange termijn werken; Hoewel dit probleem vol zit met de LSD-NIHM-batterijen. Evenzo hebben Ni-HM-batterijen of batterijen zeer stabiele thermische kenmerken, die in een breed scala van temperaturen worden bewerkt zonder een risico te vertegenwoordigen.
Reacties
De reacties die zich voordoen in hun elektroden zijn:
Ni (oh)2(s)+ oh-(AC) ⇌ NIO (OH) (S) + H2Of (l) + e-
H2Of (l) + m (s) + e- ⇌ Oh-(AC)+ MH (s)
- Ion-litio batterijen
 Lithium-ion batterij van een laptop. Bron: Kristoferb van Wikipedia.
Lithium-ion batterij van een laptop. Bron: Kristoferb van Wikipedia. In de batterijen en lithiumbatterijen zijn ze gebaseerd op de migratie van de li -ionen+, die worden overgebracht van de anode naar de kathode, product van elektrostatische afstotingen door de groeiende positieve lading.
Sommigen kunnen opladen, zoals laptopbatterijen (superieure afbeelding), en andere, cilindrisch en rechthoekig (glad2, Lisocl2 of limo2) Nee.
Ion-litio-batterijen worden gekenmerkt door zeer licht en energie te zijn, waardoor ze kunnen worden gebruikt in veel elektronische apparaten, zoals smartphones en medische apparatuur. Ze lijden ook nauwelijks van het geheugeneffect, hun laaddichtheid overschrijdt die van NICAD- en NI-HM-batterijen en batterijen en vertragen meer bij het downloaden.
Ze zijn echter erg gevoelig voor hoge temperaturen, zelfs exploderen; En bovendien zijn ze meestal duurder voor andere batterijen. Toch worden lithiumbatterijen op de markt met goede ogen gezien, en veel consumenten kwalificeren ze als de beste.
- Zure loodbatterijen
 Typische carf -auto -batterijbatterij. Bron: TntFlash [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Typische carf -auto -batterijbatterij. Bron: TntFlash [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] En ten slotte bevat zuur lood bacteriën, zoals de naam al aangeeft, geen oh ionen- Maar h+; In het bijzonder een geconcentreerde oplossing van zwavelzuur. Voltaïsche cellen bevinden zich in hun dozen (bovenste afbeelding), waar drie of zes daarvan in serie kunnen worden gekoppeld, waardoor een batterij van respectievelijk 6 of 12 V krijgt.
Het is in staat om grote hoeveelheden elektrische lading te genereren, en omdat ze erg zwaar zijn, zijn ze bestemd voor toepassingen of apparaten die niet handmatig kunnen worden getransporteerd; Bijvoorbeeld auto's, zonnepanelen en onderzeeërs. Deze zure batterij is de oudste en is nog steeds van kracht in de auto -industrie.
Uw elektroden zijn gemaakt van lood: PBO2 Voor kathode en sponsachtige metalen lead voor anode. De reacties die erin voorkomen, zijn:
PB (S) +HSO-4(aq) → pbso4(s) +h+(aq) + 2e-
PBO2(S) +HSO-4(aq) + 3H+(aq) + 2e- → PBSO4(s) + 2H2Of (l)
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Odunlade Emmanuel. (24 juli 2018). Verschillende soorten batterijen en de toepassingen. Circuit Digest. Hersteld van: CircuitDigest.com
- PRBA. (S.F.)). Soorten batterijen. Hersteld van: prba.borg
- Isidor Buchman. (2019). Wat is de beste batterij? Batterijuniversiteit. Opgehaald uit: batterij -universiteit.com
- De McGraw-Hill-bedrijven. (2007). Hoofdstuk 12: Batterijen. [PDF]. Hersteld van: Oakton.Edu
- Shapley Patricia. (2012). Veel voorkomende batterijtypen. Universiteit van Illinois. Hersteld van: Butane.Chem.Uiuc.Edu
- Ecologische houding. (22 januari 2017). Soorten batterijen: complete gids met batterijen en batterijen die bestaan. Opgehaald uit: Eccological.com
- « Tomás mejía biografie, militaire carrière, schieten
- Zure anhydriden hoe worden gevormd, toepassingen en voorbeelden »

