Kleuring van sporen
- 4818
- 1439
- Irving McClure I
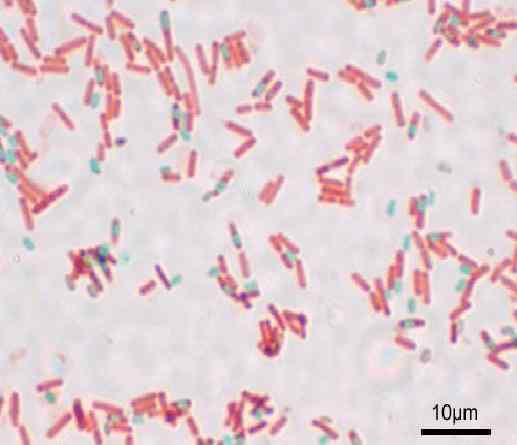
 Kleuring van sporen door de methode Shaeffer-Fulton of Wirtz-Conklin. Bron: y ook (originele uploader) [gfdl (http: // www.GNU.Org/copyleft/fdl.html) of cc-be-sa-3.0, Wikimedia Commons
Kleuring van sporen door de methode Shaeffer-Fulton of Wirtz-Conklin. Bron: y ook (originele uploader) [gfdl (http: // www.GNU.Org/copyleft/fdl.html) of cc-be-sa-3.0, Wikimedia Commons Wat is de kleuring van sporen?
De Kleuring van sporen Het is de methodologie die wordt gebruikt om de resistentiestructuren te kleuren die wat bacteriële geslachten vormen wanneer ze zich in ongunstige omstandigheden bevinden. Het dient om bacteriën te identificeren.
Er zijn veel genres die sporen vormen, maar de belangrijkste zijn Bacil En Clostridium. Deze genres worden als relevanter beschouwd omdat ze pathogene soorten hebben voor de mens.
Elke bacil kan aanleiding geven tot een spore. Op het moment van het verven van het preparaat is de spore te vinden in de Bacillus (endospora) of daarbuiten (exospora). Met conventionele kleurtechnieken voor bacteriën - zoals de kleuring van gram- zijn de sporen kleurloos.
Momenteel zijn er verschillende kleurmethoden die in staat zijn om de dikke structuur van de spore te kruisen om het te verven. Deze methoden zijn zeer gevarieerd en de techniek van Dorner, de kleuring van Möeller en Shaeffer-Fulton, ook bekend als Wirtz-Conklin.
Van alle genoemde technieken is de methodologie van Shaeffer-Fulton het meest gebruikt in routinematige laboratoria. Zijn naam verschuldigd aan twee microbiologen die de kleur hebben gecreëerd in 1930: Alicia Shaeffer en MacDonald Fulton. Soms wordt de techniek echter Wirtz-Conklin genoemd ter ere van twee 1900 bacteriologen.
Basis
De sporen zijn niet geverfd met conventionele kleuren omdat ze een zeer dikke muur hebben. De complexe samenstelling van de sporen voorkomt de binnenkomst van de meeste kleurstoffen.
Als de spore van buiten naar binnen wordt bestudeerd, worden de volgende lagen waargenomen: ten eerste is er het exosporium, dat de beste en meest externe laag is gevormd door glycoproteïnen.
Dan komt de nagelriem, die weerstand biedt tegen hoge temperaturen, gevolgd door de cortex bestaande uit peptidoglycan. Vervolgens is er de basis van de basis die de protoplast beschermt.
De spore is een uitgedroogde structuur die 15% calcium- en dipycolinezuur bevat. Daarom zijn de meeste sporenkleuringstechnieken gebaseerd op warmtetoepassing, zodat de kleurstof de dikke structuur kan doordringen.
Kan u van dienst zijn: lactogenese: kenmerken en fasenZodra de spore is gekleurd, kan deze de kleurstof niet elimineren. In de Shaeffer-Fulton-techniek komt het groen van Malachite vegetatieve cellen binnen en dringt door warmte toe.
Bij het wassen met water wordt de kleurstof uit de vegetatieve cel verwijderd. Dit gebeurt omdat de groene kleurstof van Malachite enigszins basic is, dus de vegetatieve cel bindt zwak.
In plaats daarvan kunt u niet uit de spore komen en uiteindelijk wordt de bacil met safranine aangenomen. Deze stichting is geldig voor de rest van de technieken, waarin iets soortgelijks gebeurt.
Sporen kleurtechnieken
Om de kleuring van sporen uit te voeren, moet u een pure oogst van de verdachte spanning hebben die u wilt bestuderen.
Het gewas wordt 24 uur aan extreme temperaturen onderworpen om het micro -organisme tot sporulair te stimuleren. Hiervoor kan het gewas 24 of 48 uur in een 44 ° C of in de koelkast (8 ° C) worden geplaatst.
Als u te lang vertrekt bij de bovengenoemde temperaturen, zullen alleen exospaurs worden waargenomen, omdat alle endosporen de bacil hebben verlaten.
Culmineerde tijd, een paar druppels steriele fysiologische oplossing op een schone dia moeten worden geplaatst. Dan wordt een klein deel van het gewas genomen en een uitgebreide boete.
Vervolgens is het toegestaan om te drogen, het is gefixeerd in de hitte en kleurstof met enkele van de onderstaande technieken:
Dorner -techniek
- Bereid in een testbuis een geconcentreerde suspensie van het micro -organisme gesporuleerd in gedestilleerd water en voeg een gelijk volume Fenicada Fuchsina van Kinyoun gefilterd toe.
- Plaats de buis in een bad met kokend water gedurende 5 en 10 minuten.
- Op een schone dia mengde een druppel van de vorige suspensie met een druppel waterige nigrosine -oplossing met 10%, gekookt en gefilterd.
- Uitgaven en droog met zachte warmte.
- Onderzoek met 100x doelwit (onderdompeling).
De sporen zijn geverfd rood en bacteriecellen lijken bijna kleurloos tegen een donkergrijze achtergrond.
Kan u dienen: Helmintology: Origin, What Studies, Voorbeeld van onderzoekGemodificeerde Dorner -techniek
- Een verlengde een van een ophanging van het gesporuleerde micro -organisme wordt gemaakt op een dia en vastgesteld aan warmte.
- Het monster is bedekt met een filterpapierstrook waaraan fenicada fuchsin wordt toegevoegd. De kleurstof wordt 5 tot 7 minuten verwarmd met de vlam van de bunsenen lichter totdat dampdetachement is gegenereerd. Dan wordt het papier ingetrokken.
- De voorbereiding met water wordt gewassen en droogt vervolgens met absorberend papier.
- Het uitstrijkje is bedekt met een dunne film van 10%nigrosine, met behulp van een tweede dia om nigrosine of een naald te verlengen.
De kleuring van sporen en bacteriën is gelijk aan die beschreven in de vorige techniek.
Shaeffer-Fulton of Wirtz-Conklin-techniek
- Maak een uitgebreide boete met een ophanging van gesporuleerd micro -organisme op een dia en repareer de warmte.
- Bedek de dia met waterige groene malachietoplossing op 5% (een filterpapier kan op het blad worden geplaatst).
- Verwarm op de vlam van Bunsen's lichter totdat deze dampdetachement veroorzaakt en verwijder de vlam. Herhaal de bewerking 6 tot 10 minuten. Als tijdens de procedure de malachite groene oplossing verdampt, kan er meer worden toegevoegd.
- Verwijder het filterpapier (indien geplaatst) en was met water.
- Bedek de dia met 0,5% waterige safranine gedurende 30 seconden (sommige varianten van de techniek gebruiken 0,1% waterige safranine en laat deze 3 minuten achter).
Met deze techniek worden de sporen groen gepresenteerd en de rode bacillen.
Het heeft het ongemak dat de endosporen van jonge gewassen niet goed zijn geverfd, omdat ze er extreem duidelijk of kleurloos uitzien. Om dit te voorkomen wordt het aanbevolen om 48 -uur incubatiegewassen te gebruiken.
Möeller -techniek
- Bedek het uitstrijkje met chloroform gedurende 2 minuten.
- Chloroform weggooien.
- Bedek 5 minuten met 5% chroomzuur.
- Was met gedestilleerd water.
- Het blad met fuchsin-fenicada carbol is bedekt en blootgesteld aan de vlam van de bunsenen lichter tot de emissie van dampen, dan wordt het enkele ogenblikken uit de vlam verwijderd. De bewerking wordt tot 10 minuten herhaald.
- Was met water.
- Gebruik verzuurde ethanol (hydrochlooralcohol) om te verkleuren. Het wordt 20 of 30 seconden achtergelaten.
- Was met gedestilleerd water.
- Verhuur het vel gedurende 5 minuten met methyleenblauw met methyleenblauw.
- Was met gedestilleerd water.
- Het is toegestaan om te drogen en het monster naar de microscoop te brengen.
De sporen zien er rood uit en de blauwe bacillen. Het is belangrijk om niet te streven naar dampen, omdat ze giftig zijn en op de lange termijn kunnen ze carcinogeen zijn.
Möeller -techniek aangepast zonder warmte
In 2007 creëerden Hayama en zijn medewerkers een aanpassing van de techniek van Möeller. Ze elimineerden de kleuring van de kleurstof en vervingen deze door de toevoeging van 2 druppels van de oppervlakteactieve stoffen tergitol 7 voor elke 10 ml fuchsine-gevoed carboloplossing. Dezelfde resultaten werden verkregen.
Toepassingen
De kleuring van sporen biedt zeer waardevolle en bruikbare informatie voor de identificatie van de ziekteverwekker, omdat de aanwezigheid van dezelfde, zijn vorm, locatie in de bacillus en het vermogen om de vegetatieve cel te vervormen of niet, gegevens zijn die de soort kunnen begeleiden de soorten die betrokken zijn binnen een bepaald geslacht.
In deze context is het de moeite waard om te zeggen dat de sporen rond of ovaal kunnen zijn, ze kunnen zich in het midden bevinden of ook in een palacentrale, subterminale of terminale positie.
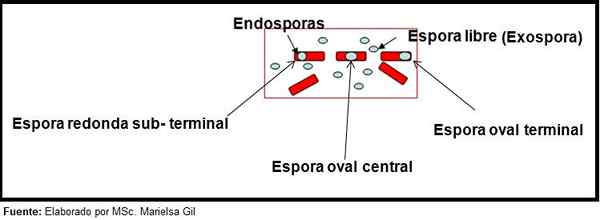 Schema van de vorm en positie van endospores en exospore
Schema van de vorm en positie van endospores en exospore Voorbeelden
- Clostridium difficile Het vormt een ovale spore in een terminale positie die de bacil -.
- De spore van Clostridium Tertium Het is ovaal, vervormt de bacil niet en bevindt zich op het terminalniveau.
- De endospora van Clostridium Tetani Het is terminal en vervormt de bacil, waardoor het uiterlijk van een trommelstick wordt.
- De sporen van Clostridium botulinum, C. histolyticum, C. Novy En C. septicum Ze zijn rond of ovaal, ondergronds en vervormen de bacil.
- De endospora van Clostridium sordelli Het bevindt zich in de centrale positie, met een lichte vervorming.
Referenties
- Moeller vlekken. Opgehaald van.Wikipedia.borg.
- Endospora. Hersteld van ES.Wikipedia.borg.
- Forbes, B., Sahm, D., Weissfeld, een. Bailey & Scott microbiologische diagnose. Pan -Amerikaanse redactionele s.NAAR.

