Acid-Bases Arrhenius, Bronsted-Lowry-theorieën, Lewis

- 4676
- 49
- Miss Herman Russel
 Grafiek die de drie hoofdtheorieën van zuren en basen relateert. Bron: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons
Grafiek die de drie hoofdtheorieën van zuren en basen relateert. Bron: TEM5PSU, CC BY-SA 3.0, via Wikimedia Commons Wat zijn zuur- en basistheorieën?
Zure en basistheorieën zijn een reeks conceptuele bijdragen die zuren en basen definiëren en onderscheiden, twee conglomeraten van immense relevantie -stoffen op het gebied van chemie.
De wortels zijn afkomstig van de eerste karakteriseringen van Robert Boyle in 1661, die zuren zoals zure en corrosieve stoffen definieerden die de kleur van het blauwe veerpapier veranderen; En de bases zoals zeepachtige stoffen die, in tegenstelling tot zuren, de kleur van het rode in blauw scheenbeen papier veranderen.
Antoine Lavoisier stelde voor dat alle zuren zuurstofatomen bevatten, zoals h2SW4 en HNO3. Eeuwen later in 1811 ontdekte Humphry Davy dat veel zuren eigenlijk geen zuurstofatomen bezaten, zoals HCl, HF, HBR, enz.
En kort voor het verschijnen van de beroemde zuur-base triade (superieure afbeelding), suggereerde Justig Liebig dat zuren waterstofatomen hebben die kunnen worden vervangen door metalen kationen.
Deze empirische kennis diende als inspiratie voor de huidige theorieën van zuren en basen: Arrhenius, Bronsted-Lowry en Lewis. Zoals te zien in de grafiek, is de theorie van Arrhenius de meest beperkende of beperkte van allemaal, terwijl Lewis de meest algemene en geglobaliseerde is.
Arrhenius -theorie
Voorgesteld in 1884 door Svante Arrhenius, zegt zijn theorie dat zuren wanneer opgelost in water ionen helen h3OF+ of h+; Terwijl de bases, wanneer het oplost in water, oh ionen produceren of vrijgeven-.
De ionen h3OF+ en oh- Ze combineren in een omkeerbare reactie die aanleiding geeft tot watermoleculen:
H3OF+ + Oh- ⇌ 2H2OF
Kan u van dienst zijn: disulfurinezuur: wat is, structuur, eigenschappen, gebruikDus een arheniuszuur is ook degene die de concentratie van H -ionen verhoogt3OF+, Terwijl een Arrhenius -basis er een is die de ionenconcentratie verhoogt OH-.
Dit betekent dat een arheniuszuur niet noodzakelijkerwijs H -ionen mag bevatten3OF+, En een Arrhenius -basis hoeft geen oh ionen te hebben- In zijn structuur.
Voorbeeld en beperkingen
Overweeg de volgende dissociaties:
HCl (AC) → H+(AC) +Cl-(AC)
NaOH (AC) → NA+(AC) +OH-(AC)
HCl is een arrhenius -zuur omdat wanneer het in water wordt opgelost, het h -ionen produceert+, of meer correct, H -ionen3OF+. En aan de andere kant is NaOH een Arrhenius -basis omdat wanneer het wordt opgelost in water, oh ionen releases-. Deze stoffen reageren op elkaar om zout en water te produceren:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2OF
Het probleem met Arrhenius -theorie ligt in het feit dat het alleen beperkt is tot waterige oplossingen en daarom alleen van toepassing is op stoffen die oplosbaar zijn in water. De MGO is bijvoorbeeld erg onoplosbaar in het water, en toch is het een basisoxide.
Het is ook niet in staat om voor zichzelf uit te leggen hoe stoffen zoals NH3 en Cao produceren oh ionen- opgelost in water, zelfs als ze geen ionen hebben oh- In zijn moleculaire of kristallijne structuur (zoals het geval is van NaOH of KOH).
En hij legt niet uit hoe de CO2 kan ionen vrijgeven h3OF+ In water zonder waterstofatoom in zijn moleculaire structuur (zoals het geval is met HCl of H2SW4)).
Brönsted-Lowry-theorie
Voorstel individueel in 1923 door Johannes Bronsted en Thomas Lewry, zegt hun theorie van zuren en basen dat een zuur al die stof is die ionen hogt H kan doneren+, en dat een basis in plaats daarvan elke stof is die deze h kan accepteren+. Deze theorie is algemener dan die van Arrhenius en omvat verschillende van zijn beperkingen.
Kan u van dienst zijn: molaire oplossingen: concept, voorbereiding, voorbeeldenVoorbeeld
Overweeg de neutralisatievergelijking tussen H opnieuw3OF+ en een oh- Om twee watermoleculen te produceren:
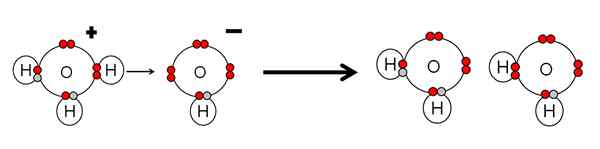 Voorbeeld van zuurneutralisatie en waterbasis. Bron: Gabriel Bolívar.
Voorbeeld van zuurneutralisatie en waterbasis. Bron: Gabriel Bolívar. Merk op dat h3OF+ Heb een h gedaan+ die onmiddellijk worden gekoppeld of gecoördineerd met de OH- Juist -recht. Wanneer h+ Het eindigt gekoppeld aan een van de elektronenvrije paren van de OH-, Twee neutrale watermoleculen blijven als producten.
De H3OF+ Daarom is het een brnsted-lowry zuur, voor het doneren van de h+, en de oh- Het is een brnsted-lowry-basis voor het accepteren van deze h+.
Een ander voorbeeld van een zuurbasisreactie is als volgt:
NH3(G) + HCl (G) → NH4CL (S)
Volgens Arrhenius kon deze reactie niet worden beschouwd als het zuur-base type omdat het niet plaatsvindt in waterig medium maar in de stoomfase of in een gasvormige toestand. De NH3 Het is een BRNsted -basis omdat het de HCL H accepteert door een paar elektronen op het stikstofatoom te doneren; En de HCL, logisch, wordt het brnsted zuur.
De MGO is dus een BRNsted -basis omdat hij H kan accepteren+ van zuren om te transformeren in Mg (OH)2.
Lewis -theorie
De theorie van Bronsted-Lowry verklaart een breed spectrum van zuurbasisreacties. Negeer echter die reacties waar H -ionen+ en oh- Ze zijn helemaal niet betrokken, evenals een grotere deelname van vrije elektronen in moleculaire mechanismen.
Dus in 1923 g. N. Lewis stelde een zuur-base theorie voor die het volgende zegt: een zuur is elke stof die in staat is om paren van elektronen te accepteren, terwijl een basis er een is die deze elektronenparen schenkt.
Het kan u van dienst zijn: DAPI (4 ', 6-diamidino-2-fenylindol): kenmerken, fundering, gebruikBijvoorbeeld ion h+ Het is een Lewis -zuur omdat het elektronenparen van alle soorten in de buurt accepteert: van H2Of om h te komen h3OF+, van NH3 Om NH te ontstaan4+, enz.
Voorbeeld en voordelen
Overweeg een ander voorbeeld in de volgende reactie:
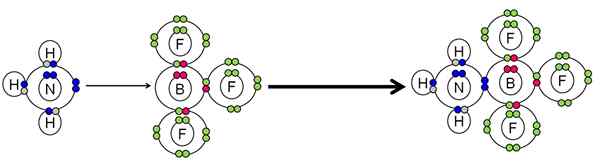 Voorbeeld van neutralisatie tussen een zuur en een Lewis -basis. Bron: Gabriel Bolívar.
Voorbeeld van neutralisatie tussen een zuur en een Lewis -basis. Bron: Gabriel Bolívar. De NH3 Een paar elektronen (blauw) van het stikstofatoom gedaan naar de BF Boron Atom3. Daarom de NH3 Het is de basis van Lewis omdat het paar elektronen en de BF doneert3 Het is het zuur van Lewis omdat hij ze accepteert.
Over het algemeen zijn kationen en slechte elektronensoorten Lewis -zuren, terwijl anionen en elektronenrijke soorten Lewis Bases zijn.
De aangeboden voordelen.
Bijvoorbeeld: h2O Het heeft vrije elektronen in zuurstof. Als je een van hen doneert aan een ion h+, zal fungeren als een Lewis -basis, zijnde de h+ Bijgevolg Lewis Acid.
Volgens Bronsted-Lowry, h2Of ik zou als basis fungeren omdat het H precies accepteert+ Door een paar van hun gratis elektronen te doneren. En tot slot, h2Of het is ook een basis volgens de theorie van Arrhenius omdat de concentratie van H -ionen afneemt+ in de waterige omgeving, en bijgevolg de concentratie van OH -ionen verhogen-.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Clark Jim. (2002). Theorieën van zuren en basen. Hersteld van: chemguide.co.Uk
- Broderick C., Moussa m., & Clark J. (21 augustus 2020). Overzicht van zuren en basen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Wikipedia. (2020). Zuur-base reactie. Opgehaald uit: in.Wikipedia.borg
- Texas A&M University. (S.F.)). Zuren en basen: ontwikkeling van zuren en basen. Hersteld van: chem.tamu.Edu

