Waterstofbruggen
- 1615
- 441
- Nathan Wiegand
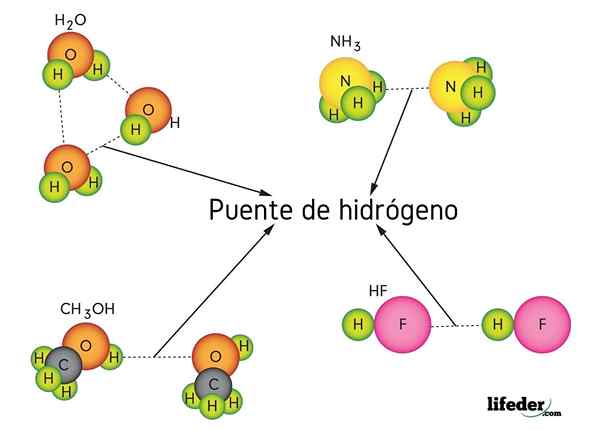
 Waterstofbrug in water (h2O), methanol (cho3OH), waterstoffluoride (HF) en ammoniak (NH3)
Waterstofbrug in water (h2O), methanol (cho3OH), waterstoffluoride (HF) en ammoniak (NH3) Wat is een waterstofbrugverbinding?
De waterstofbrug is een speciaal type dipool-dipolo-interactie, behorend tot de Van der Waals-krachten, waarbij een waterstofatoom zich bij twee of meer moleculen verbindt zonder covalent te worden verbonden. Er is geen sprake van een elektronencompartiment, maar van een voornamelijk elektrostatisch fenomeen.
Zoals de naam al doet vermoeden, werkt waterstof als een brug, dus het moet tussen twee atomen zijn. Waterstof is verbonden (H-X) met een zeer elektronegatief atoom (zoals N, O en F), en benadert een ander elektronegatief atoom maar van een aangrenzend molecuul. Dit resulteert in de vorming van de waterstofbrug x ··· h-x.
Merk op dat in de X ··· H-X-weergave de punten de waterstofbrug symboliseren, terwijl het script de covalente binding tussen H en X vertegenwoordigt. Dat gezegd hebbende, laten we eens kijken naar de waterstofbrug tussen twee watermoleculen, waarbij X het zuurstofatoom is: H2Of ··· H-OH (lagere afbeelding).
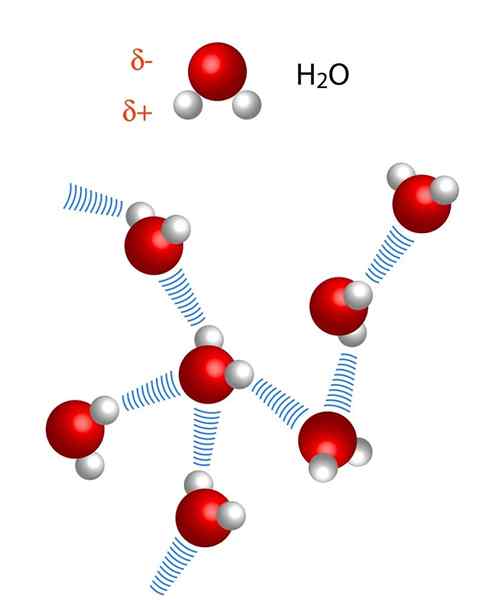
In het bovenstaande beeld zien we dat zeven watermoleculen samen blijven dankzij hun waterstofbruggen, weergegeven door blauwe lijnen. Een waterstofbrug alleen is niet erg sterk, maar als er miljarden van hen zijn, geven ze de zaak abnormale en onverwachte eigenschappen.
Kenmerken van de waterstofbrug
Samenstelling
De waterstofbrug moet echt worden weergegeven als X '··· H-X, waarbij X bekend staat als de waterstofbrugdonor, omdat deze covalent is gekoppeld aan waterstof (het geeft het).
Ondertussen is x 'de acceptor van de waterstofbrug, aanwezig in een naburig molecuul (ontvangt het). We hebben dus een donoratoom (x), een waterstof (h) en een acceptoratoom (x ') die de waterstofbrug samenstellen (x' ··· h-x).
Geometrisch
Als we aan een brug denken, komen platte of gebogen oppervlakken in me op. Omdat wordt aangenomen dat de links niet kromming zijn, hebben we dan twee afstanden: x ··· h en h-x, die de waterstofbrug vormen x ··· h-x.
Kan u van dienst zijn: onomkeerbare reactie: kenmerken en voorbeeldenTussen deze twee afstanden is er een hoek, die vaak 180 ° is; Dat wil zeggen, de drie atomen van onze brug rusten op dezelfde horizontale (of verticale) lijn.
Wanneer de hoek verschilt van 180º, is de X ··· H-X-brug niet langer recht of lineair, maar verwerft andere geometrieën.
Aan de andere kant zijn afstanden in waterstofbruggen niet identiek. De H-X-afstand is korter dan x ··· h, die te zien is in het beeld van watermoleculen. Dus bijvoorbeeld is de H-X-afstand meestal 230 pm (1 · 10-12m), terwijl de andere afstand x ··· h 160 pm is.
Associatief
Een speciaal kenmerk van de waterstofbrug is dat de moleculen veel meer met elkaar geassocieerd zijn. Ze lopen niet van kant naar een andere die elkaar negeren. Daarom stelt het een tijdelijke volgorde in de vloeistoffenborsten; En in het geval van vaste stoffen dragen ze bij aan de definitie van hun kristallen.
Waar we een waterstofbrug zien, kunnen we denken aan associatie en daarom in een bepaalde volgorde (hoewel dynamisch en veranderen) naar moleculaire schalen.
Energie
Het breken van een waterstofbrug is niet erg moeilijk. Watermoleculen, bijvoorbeeld lopen en creëren elke keer tijdens het mobiliseren. Maar het doorbreken van velen van hen zou tegelijkertijd een eindeloos aantal moleculen inhouden. We praten over het leveren van een dergelijke energie die mol breekt van deze waterstofbruggen (6.02 · 1023 X ··· H-X).
Aldus varieert de kracht van de waterstofbrug afhankelijk van de identiteiten en aard van de moleculen. De kracht van de waterstofbrug of ··· H-O tussen water en alcohol is bijvoorbeeld 5 kcal/mol: 5 kcal energie is nodig om een mol van die waterstofbrug in kwestie te breken.
Kan u van dienst zijn: chemische veranderingen: kenmerken, voorbeelden, typenVoorbeelden van waterstofbruggen
Water
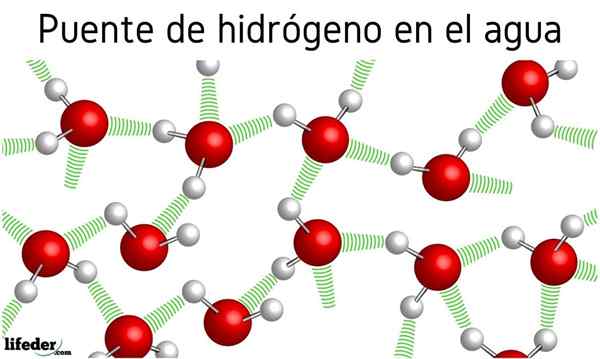
In het begin was er sprake van waterstofbruggen tussen de watermoleculen, maar het effect dat het heeft op hun eigenschappen werd niet genoemd. Dankzij hen kookt het water op 100 ° C, waardoor de kookpunten van gerelateerde moleculen zoals H achterbleven2S, die kookt op -60 ºC; of h2Ik weet het, kook op -41.25 ºC.
Dit verschrikkelijke verschil is te wijten aan waterstofbruggen van water, die ook andere afwijkende eigenschappen definiëren, zoals hun enorme specifieke warmte, ijskristallen, hun diëlektrische constante, enz.
Ethanol
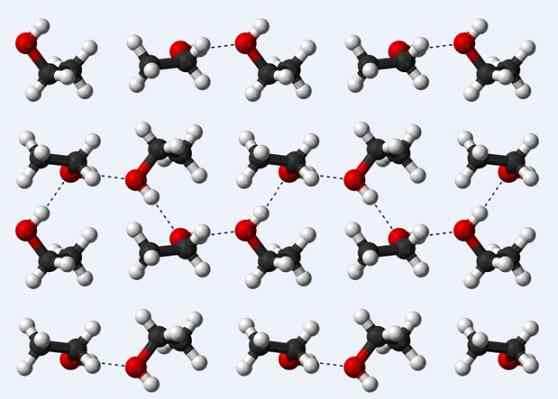 Waterstofbruggen in een ethanolkristal
Waterstofbruggen in een ethanolkristal Laten we nu een andere waterstofbrug bekijken: die tussen ethanolmoleculen, CH3Ch2Oh (hierboven). Merk op hoe de moleculen worden ondergebracht3Ch2Oh op zo'n manier dat hun waterstofbruggen zijn gevestigd3Ch2Ho ··· hoch2Ch3 (stippellijntjes).
De moleculen zijn echter te bevolen om aan te nemen dat we het hebben over vloeibare ethanol, maar in plaats daarvan een glas verzinnen (vaste ethanol).
De waterstofbrug beschreven voor ethanol is vergelijkbaar met die van de andere alcoholen, met het verschil dat hun koolzuurhoudende skeletten de efficiëntie van genoemde bruggen kunnen belemmeren.
Azijnzuur
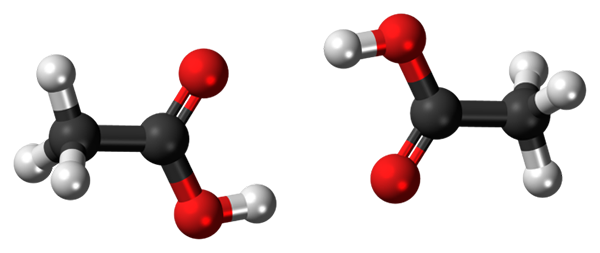 Waterstofbruggen tussen twee azijnzuurmoleculen. Bron: Jynto, CC0, via Wikimedia Commons
Waterstofbruggen tussen twee azijnzuurmoleculen. Bron: Jynto, CC0, via Wikimedia Commons Azijnzuur, cho3COOH, is in staat om twee waterstofbruggen vast te stellen die twee moleculen tegelijkertijd verenigen. Omdat het twee moleculen zijn die zijn gekoppeld door de waterstofbruggen, praten we over een dimeer.
Merk op dat een van deze waterstofbruggen C = O ··· H-O is en de andere O-H ··· O = C. Azijnzuur presenteert de eigenaardigheid dat het in de dampfase bestaat als deze dimeer.
Het kan je van dienst zijn: manganisch of permanganinezuurCellulose
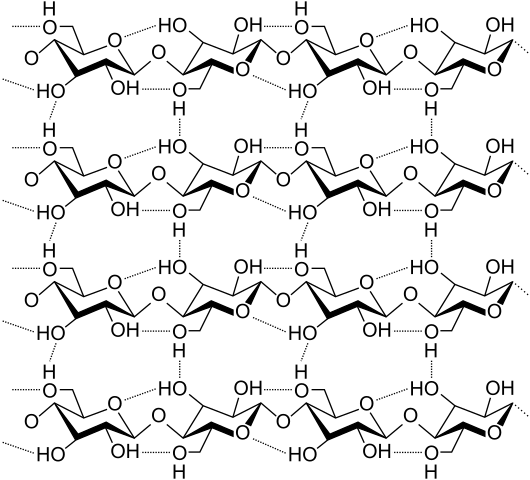 Waterstofbruggen tussen verschillende celluloseketens. Bron: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons
Waterstofbruggen tussen verschillende celluloseketens. Bron: Laghi.L, CC BY-SA 3.0, via Wikimedia Commons Laten we nu meer diverse en meerdere waterstofbruggen zien. Cellulose, een natuurlijk polymeer, bestaat uit ketens samengesteld uit verschillende eenheden van β-glucose.
Elke keten blijft aan een andere gefixeerd dankzij veel waterstofbruggen (superieure afbeelding), die de cohesie tussen de ketens versterken.
DNA
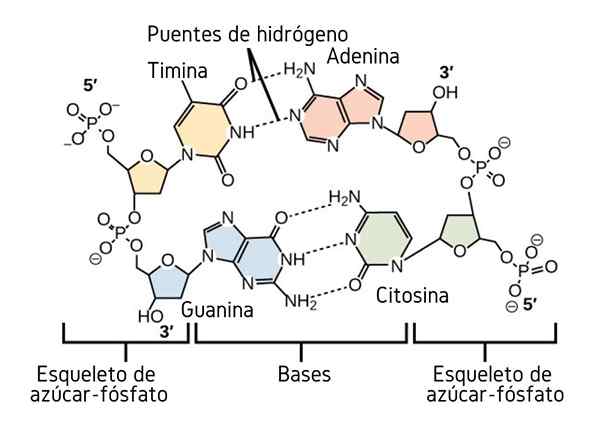 Waterstofbruggen tussen de stikstofbases van DNA. Bron: CNX OpenStax, CC door 4.0, via Wikimedia Commons
Waterstofbruggen tussen de stikstofbases van DNA. Bron: CNX OpenStax, CC door 4.0, via Wikimedia Commons Tot nu toe hebben we het associatieve effect van waterstofbruggen gezien om orde tussen de moleculen op te leggen. Maar hoe zit het met een macromolecuul? In een macromolecuul, zoals DNA, vinden we interne of intramoleculaire waterstofbruggen tussen de thymine, adenine, guanine en cytosine (boven) (boven) (hierboven).
Intramoleculaire waterstofbruggen tussen deze stikstofbaseparen, zorgt ervoor dat het DNA -molecuul een dubbele propellerstructuur verwerft, die ideaal is voor de replicatie ervan. Als deze waterstofbruggen worden verbroken door verwarming, zal de dubbele propeller eindigen in twee afzonderlijke segmenten of banden.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Edward E. Ávila & Asilé J. Bramen. (2004). De waterstofbrug en zijn toepassingen link. Universiteit van Los Andes, Faculteit der Wetenschappen, Afdeling Chemie.
- Wikipedia. (2020). Waterstofbinding. Opgehaald uit: in.Wikipedia.borg
- Pietri J. & Clark J. (21 augustus 2020). Waterstofbinding. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- De redacteuren van Enyclopaedia Britannica. (2020). Waterstofbinding. Hersteld van: Britannica.com
- Helmestine, Anne Marie, pH.D. (29 oktober 2020). Wat zijn voorbeeld van waterstofbinding? Hersteld van: Thoughtco.com

