Moleculaire orbitale theorie

- 3803
- 243
- Nathan Wiegand
Wat is moleculaire orbitale theorie?
De Moleculaire orbitale theorie (TOM) Het is een wiskundig model dat is ontwikkeld om de fysicochemische eigenschappen van moleculen te verklaren, zoals de absorptie en emissie van straling, elektrische geleidbaarheid, evenals de elektronische aard van zijn links. Dit beschouwt, in tegenstelling tot de Valencia Link Theory (TEV), dat elektronen in het hele molecuul worden verplaatst, zonder zich waarschijnlijk in de links te bevinden.
Daarom past de moleculaire orbitale theorie dezelfde kwantumprincipes toe die de golffuncties dicteren voor atomaire orbitalen, waardoor de energietoestand van elektronen in atomen wordt beschreven; Pas nu richt zich op de zo -called moleculaire orbitalen, afkomstig van de lineaire combinaties van de atomaire orbitalen van de atomen die zijn gekoppeld.
 Het paramagnetisme van vloeibare zuurstof, en daarom wordt de aantrekkingskracht ervan voor magneten uitgelegd dankzij de moleculaire orbitale theorie. Bron: Pieter Kuipeper via Wikipedia.
Het paramagnetisme van vloeibare zuurstof, en daarom wordt de aantrekkingskracht ervan voor magneten uitgelegd dankzij de moleculaire orbitale theorie. Bron: Pieter Kuipeper via Wikipedia. De moleculaire orbitale theorie werkt dan, werkend met moleculaire orbitalen, hun elektronische en ruimtelijke distributies, evenals de diagrammen van hun respectieve energieën, die het mogelijk maken om de energiekloven te observeren die hen scheiden. Bovenal verklaart het paramagnetisme van bepaalde stoffen, zoals moleculaire zuurstof in vloeibare toestand (zie hierboven).
De O2, Beschreven door Lewis 'structuren en de linktheorie van Valencia, heeft het al zijn gepaarde elektronen, dus in theorie zou het diamagnetisch moeten zijn. In de praktijk is echter aangetoond dat het eigenlijk paramagnetisch is, dat wil zeggen dat het elektronen ontbreekt; Specifiek een paar ontbrekende elektronen.
Van de constructie van het OM -diagram (moleculaire orbitalen) voor de O2, Een homonucleair diatomisch molecuul, het is te zien dat er effectief twee high -energy ontbrekende elektronen zullen zijn. Niet alleen dit, maar de spin en positie van deze elektronen in de OMS verklaren ook andere elektronische toestanden van de of2 (enkel).
Andere van de belangrijkste triomfen van de moleculaire orbitale theorie is dat het helpt bij het voorspellen van het mogelijke bestaan van diatomaire moleculen, evenals hun relatieve stabiliteit. Aldus is de moleculaire orbitale theorie recht in de voorspelling van moleculen zoals B2 En Li2, Zelfs wanneer ze alleen in de dampfase kunnen detecteren bij hoge temperaturen. Ook verwerpt deze theorie het bestaan van de hypothetische die ik heb2 of ne2.
Soorten moleculaire bindingen en orbitalen
Net als bij de Valencia Link Theory, worden in de moleculaire orbitale theorie in verschillende soorten links beschouwd, afhankelijk van de directionaliteit van de overlapping van atomaire orbitalen die deelnemen aan de chemische binding. Een van de belangrijkste en aanwezige in moleculaire aard hebben we de Sigma- en Pi -bindingen.
Sigma
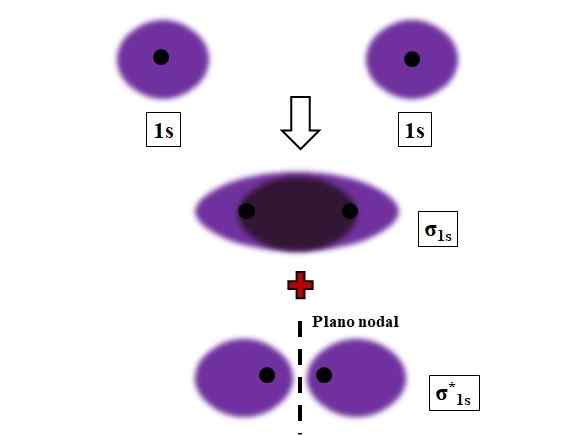 Vorming van σ1s en σ1s* links tijdens de overlap van twee atoom orbitalen 1s. Bron: Gabriel Bolívar.
Vorming van σ1s en σ1s* links tijdens de overlap van twee atoom orbitalen 1s. Bron: Gabriel Bolívar. Sigma, σ -bindingen worden vastgesteld wanneer atomaire orbitalen zich frontaal overlappen, in relatie tot een denkbeeldige internucleaire as die de twee die nadert verbindt.
Overweeg bijvoorbeeld de σ -link die wordt gevormd wanneer twee 1s atomaire orbitalen, volgens een waterstofatoom, dicht bij een zeer korte afstand zijn (afbeelding hierboven). Omdat 1s orbitalen symmetrisch zijn, zal hun overlap altijd frontaal zijn; Daarom zullen ze altijd moleculaire orbitalen genereren σ1s en σ1s*.
Merk nu op dat moleculaire orbitale σ1s toont een elektronische dichtheid geconcentreerd in de ruimte die de twee kernen scheidt. Dit betekent dat in een orbitale σ1s De kans op het vinden van een elektron is maximaal in dit gebied van de molecuul. De elektronen van σ1s Ze worden verplaatst door de ruimte die de paarse kleur bedekt.
Aan de andere kant, in de orbitale σ1s* We hebben een knooppunt tussen de twee kernen. Dit betekent dat de kans op het vinden van een elektron tussen die ruimte gelijk is aan nul. Merk op dat in de orbitale σ1s* Elektronen beschrijven posities rond elk van de twee kernen; niet rond het molecuul als geheel.
Kan u van dienst zijn: radio: structuur, eigenschappen, gebruik, verkrijgenPi
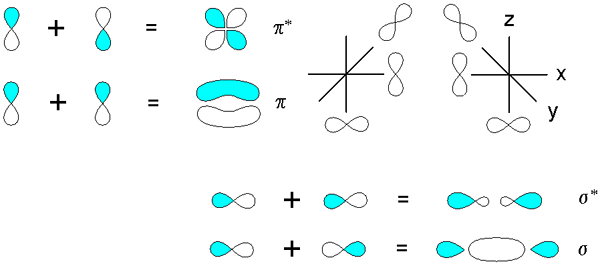 Sigma- en PI -bindingen afgeleid van de overlapping van orbitalen P. Bron: v8rik bij in.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Sigma- en PI -bindingen afgeleid van de overlapping van orbitalen P. Bron: v8rik bij in.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Overweeg nu de moleculaire bindingen en orbitalen. Deze komen voor wanneer de overlapping van de orbitalen plaatsvindt in een richting loodrecht op de internucleaire as, die willekeurig wordt gefixeerd in een van de assen van het Cartesiaanse vlak. Ervan uitgaande dat we het hebben over een 2p orbitalX, Het 2p orbitaalEn Het zal vrij zijn om een PI -link tot stand te brengen (zie blauwe en witte lobben).
Wanneer twee orbitalen 2pEn Twee moleculaire orbitalen komen voort: π2 py en π2 py*; De eerste heeft de hoogste elektronische dichtheid en onder de internucleaire as, terwijl de tweede lijkt op een bloem met vier petal, waar de kans om elektronen te vinden veel lager is.
Aan de andere kant, de orbitalen 2p, om 2p te zeggenX, Ze kunnen ook frontaal overlappen om een σ -binding en twee moleculaire orbitalen te ontstaan σ2px en σ2 px*. Zoals in het geval van σ1s en σ1s*, De orbitale σ2px toont een grotere elektronische dichtheid tussen de twee kernen; die in strijd is met σ2 px*, waar elektronen zijn gericht op de zijkanten van buiten.
Koppeling
Lindende moleculaire orbitalen zijn die die bijdragen aan de stabiliteit van de molecuul. Dat wil zeggen, ze moeten minder energie hebben in vergelijking met de atomaire orbitalen van individuele atomen voordat ze de molecuul koppelen en vormen. In deze orbitalen worden de elektronen verplaatst door alle afmetingen van het molecuul als geheel.
In de OM -diagrammen zullen deze zich altijd onder de atomaire orbitalen bevinden die zich gecombineerd hebben om ze te vormen. Dit zal in de volgende secties meer gedetailleerd worden gezien.
Anti -hut
De anti -houding moleculaire orbitalen daarentegen zijn die die de molecuul destabiliseren. Ze worden gesymboliseerd met een asterisk (*), en hun energieën zijn hoger dan die van de atomaire orbitalen die hen zijn ontstaan. In deze orbitalen worden de elektronen behoorlijk onregelmatig verplaatst, alsof het molecuul elektronisch gefragmenteerd was.
In OM -diagrammen zullen ze zich altijd boven de atomaire orbitalen bevinden die gecombineerd zijn om ze te vormen.
Niet gekoppeld
Ondertussen zijn niet -linking orbitalen, evenals hun elektronen, degenen die niet bijdragen aan of schaden de stabiliteit van de molecuul. Zijn energieën lijken erg op die van atomaire orbitalen.
Link Order
De linkorder wordt in de theorie van het moleculaire orbitaal, zoals het linknummer is in de Valencia Link -theorie: een maat voor de kracht van de link in een molecuul. Een linkorder gelijk aan 1 komt dus overeen met een eenvoudige link (-). En een linkorder (of.e) gelijk aan 2, komt overeen met een dubbele binding (=). Spoedig.
Deze volgorde wordt bepaald uit het tellen van elektronen in de OM -diagrammen voor een bepaald molecuul. Om dit te doen, moet de volgende formule worden toegepast:
of.E = (aantal gekoppelde elektronen - Aantal anti -Hut -elektronen)/2
Linkelektronen dragen bij aan het molecuul om zich te stabiliseren, terwijl anti -vierelijke elektronen het destabiliseren. Daarom, hoe meer anti -sung elektronen, hoe kleiner de of.E, en het molecuul zal de neiging hebben zeer onstabiel te zijn. Wanneer de O.E is gelijk aan 0, het betekent dat het molecuul niet bestaat (of althans in theorie).
OM -diagrammen
In de OM -diagrammen worden de energieën van de moleculaire orbitalen weergegeven en wordt ook de elektronische vulling gevisualiseerd, die de regels van Aufbauf en SINN gehoorzaamt, evenals het principe van uitsluiting van Pauling. Overweeg bijvoorbeeld de volgende twee diagrammen:
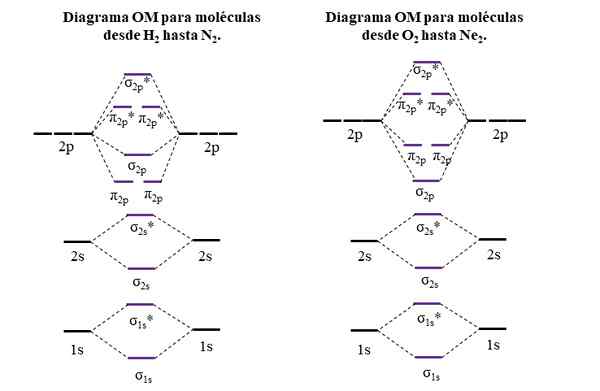 OM -diagrammen voor moleculen van de eerste en tweede periode van het periodiek systeem. Bron: Gabriel Bolívar.
OM -diagrammen voor moleculen van de eerste en tweede periode van het periodiek systeem. Bron: Gabriel Bolívar. Horizontale lijnen aan de zijkanten, zwart, vertegenwoordigen de energieën van atomaire orbitalen. In plaats daarvan zijn centrale horizontale lijnen, paars, de energieën van moleculaire orbitalen. Merk op hoe de koppeling en anti -agent OMS worden verdeeld (*) in relatie tot de atomaire orbitalen van individuele atomen.
Het kan u van dienst zijn: een aminogroep (NH2): structuur, eigenschappen, voorbeeldenMerk ook op dat in het juiste diagram, de OM σ2 p Ze veranderen van plaats met π2 p. Dit gebeurt met de moleculen van O2, F2, en de hypothetische NE2.
Voorbeelden
In de volgende voorbeelden zal de OM doorgaan met de elektronen, de linkorder berekenen en voorspellingen doen over de kracht van de binding of stabiliteit van het betreffende molecuul.
H2
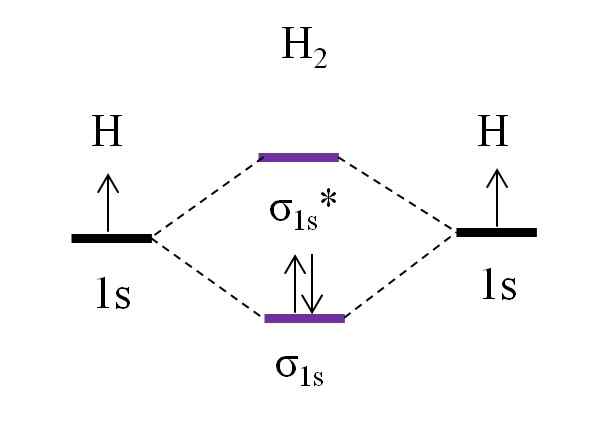 OM -diagram voor dihydrogen molecuul. Bron: Gabriel Bolívar.
OM -diagram voor dihydrogen molecuul. Bron: Gabriel Bolívar. Beginnend met het eenvoudigste molecuul, dat van dihydrogen, h2, Twee H -atomen worden gekoppeld door hun twee 1s atomaire orbitalen te combineren om twee moleculaire orbitalen te vormen σ1s en σ1s*. De twee elektronen gaan vervolgens door met het vullen van de moleculaire orbitalen.
Eerst is de orbitale σ gevuld1s, Omdat het de minste energie is (AUFBAUF -regel). Vervolgens moet het tweede elektron de vulling van de orbitale σ afmaken1s Voordat u de orbitale σ beklimt1s* (Sink -regel). En ten slotte begeleidt dit tweede elektron zijn spin in de tegenovergestelde richting van het eerste elektron (Pauling Exclusion Principle). Aldus bevinden de twee elektronen zich in de gekoppelde orbitale σ1s.
Hoe zit het met de linkorder? In de link moleculaire orbital σ1s We hebben 2 elektronen; Terwijl in de anti -hell moleculaire orbital σ1s* we hebben geen. Daarom zou de berekening zijn:
of.E = (2-0)/2
= 1
Zijn of.En gelijk aan 1, betekent dit dat de link die de twee waterstofatomen verenigt, eenvoudig is: H-H-H. Over het algemeen, als deze waarde gelijk is aan of groter dan 1, wordt gezegd dat het molecuul bestaat en stabiel is.
Hij2
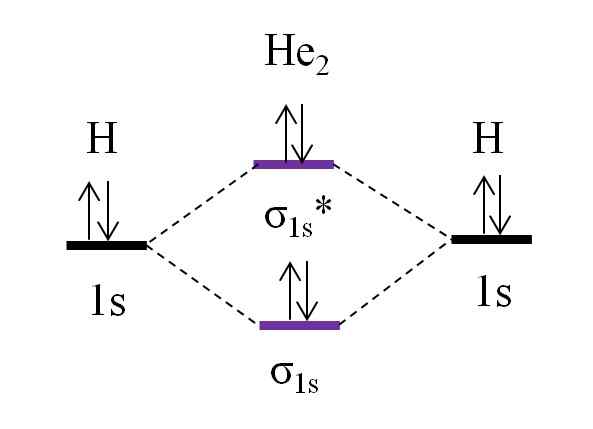 OM -diagram voor hypothetisch dihelio -molecuul. Bron: Gabriel Bolívar.
OM -diagram voor hypothetisch dihelio -molecuul. Bron: Gabriel Bolívar. Stel nu dat je het molecuul van hij hebt2. Hierboven zien we dat het OM -diagram erg lijkt op de h2, Met 2 extra elektronen die zich in de orbitale σ bevinden1s*. Wanneer er in totaal 4 elektronen zijn die de twee atomen toevoegen, moeten er ook 4 elektronen zijn in alle resulterende moleculaire orbitalen.
Het bepalen van de O.E voor de i hij2 we zullen hebben:
of.E = (2-2)/2
= 0
Dit betekent dat er geen mogelijke link is dat de twee heliumatomen. Tot op heden is het bestaan van dit molecuul zelfs niet geïdentificeerd, wat overeenkomt met de voorspellingen van de moleculaire orbitale theorie.
B2
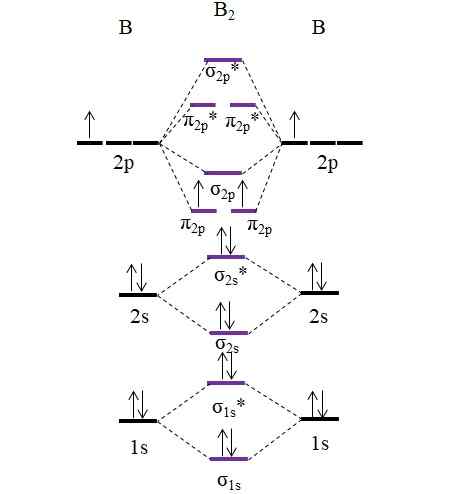 OM -diagram voor het B2 -molecuul. Bron: Gabriel Bolívar.
OM -diagram voor het B2 -molecuul. Bron: Gabriel Bolívar. Merk op dat bij de vorming van moleculaire orbitalen ook rekening wordt gehouden met de elektronen van de interne lagen; Niet alleen die van Valencia.
Dus in het voorbeeld van het Diboro -molecuul, B2, Elk booratoom draagt in totaal 5 elektronen bij, waarvan 3 uit Valencia; Dit zijn die van hun 2s en 2p orbitalen. De twee elektronen van de orbitalen 2p zijn geplaatst in verschillende moleculaire orbitalen π2 p Met parallelle stekels (zinkregel).
We gaan vervolgens door met het berekenen van de linkorder:
of.E = (6-4)/2
= 1
Daarom wordt verwacht dat het molecuul een eenvoudige B-B-link heeft. De B2 Het is een molecuul dat alleen in de stoomstadium bestaat bij zeer hoge temperaturen, omdat boor in normale omstandigheden complexere netwerkstructuren en ontwerpen aanneemt.
C2 en C22-
Overweeg eerst het OM -diagram voor molecuul C2:
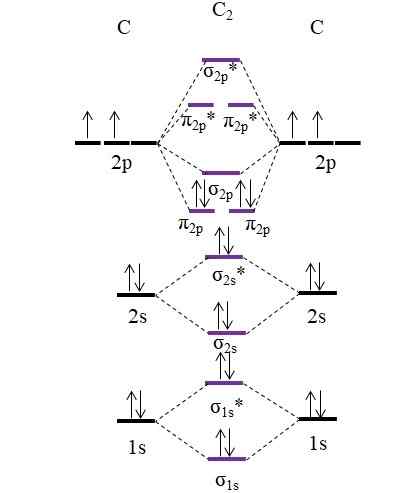 OM -diagram voor molecuul C2. Bron: Gabriel Bolívar.
OM -diagram voor molecuul C2. Bron: Gabriel Bolívar. Nu worden de twee nieuwe elektronen geleverd door koolstofatomen opnieuw geplaatst in de moleculaire orbitalen π2 p Maar met tegengestelde spins (Pauling Exclusion Principle).
Het bepalen van uw linkvolgorde die we zullen hebben:
of.E = (8-4)/2
= 2
Merk op dat moleculaire orbitalen π2 p Voeg 4 elektronenbinding toe aan de formule. Omdat deze volgorde gelijk is aan 2, betekent dit dat molecuul C2 Het heeft een dubbele binding, c = c. Nogmaals, molecuul c2, Ook wel diatomaire koolstof genoemd, er is alleen stoomfase bij hoge temperaturen, en het is een van de eenvoudigste allotrope vormen van koolstof.
En hoe zit het met c22-? Uw OM -diagram is als volgt:
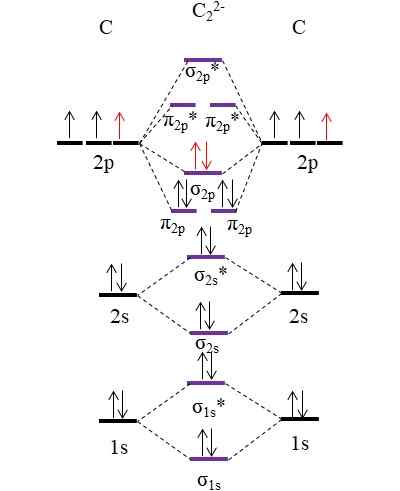 OM -diagram voor anion c22-. Bron: Gabriel Bolívar.
OM -diagram voor anion c22-. Bron: Gabriel Bolívar. De twee nieuwe elektronen (rode pijlen) zijn gepositioneerd in het koppelende moleculaire orbitale σ2 p. Dit veronderstelt dus dat elk koolstofatoom een van de twee negatieve ladingen bijdraagt (voor een oxidatietoestand van -1).
Kan u dienen: Mercury Fulminate: structuur, eigenschappen, verkrijgen, gebruikHet berekenen van uw linkorder die we zullen hebben:
of.E = (10-4)/2
= 3
Dat wil zeggen anion c22-, Ook wel anionacetyluro genoemd, het heeft een drievoudige link, [C≡C]2-. Het is een relatief stabiel anion met een grote schakelkracht; Afhankelijk van zijn tegenhanger -ionen kan het echter explosieve verbindingen ontstaan.
N2 en N2+
Het beroemde stikstofmolecuul, n2, Het kan ook perfect worden beschreven door moleculaire orbitale diagrammen te gebruiken:
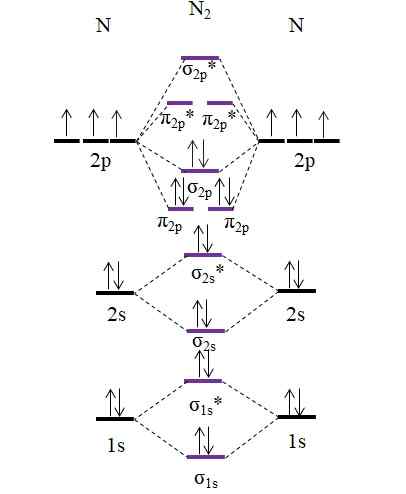 OM -diagram voor het N2 -molecuul. Bron: Gabriel Bolívar.
OM -diagram voor het N2 -molecuul. Bron: Gabriel Bolívar. Merk op dat dit diagram precies hetzelfde is als voor anion c22-. Dit betekent dat n2 en C22- Ze zijn isolectronisch. Een dergelijk feit betekent echter niet dat beide soorten zich op dezelfde manier gedragen. Dan2, Neutraal, is veel stabieler dan C22-, Negatief, zelfs als beide een link -volgorde hebben gelijk aan 3, N≡N.
En hoe zit het met kation n2+? Laten we eens kijken naar uw OM -diagram:
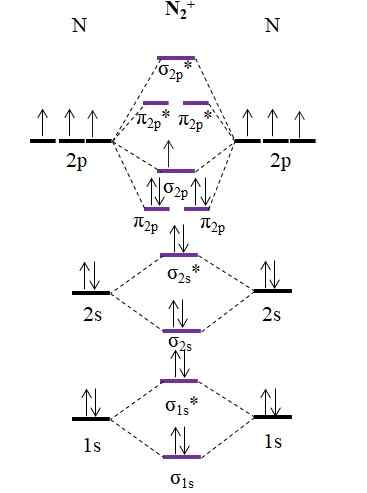 OM -diagram voor kation N2+. Bron: Gabriel Bolívar.
OM -diagram voor kation N2+. Bron: Gabriel Bolívar. Zoals kation n2+ Het heeft één minder elektron, dit wordt de moleculaire orbitale σ verwijderd2 p. Dan2 Het is diamagnetisch, terwijl de n2+ Het is paramagnetisch. En zijn linkorder is:
of.E = (9-4)/2
= 2.5
Een 2 2 -link.5 zou worden weergegeven met twee lijnen en één punt. Zoiets heeft echter niet veel zin in de theorie van Valencia of in de structuren van Lewis. Omdat deze linkorder minder dan 3 is, is de kracht van de link die aanwezig is in de n2+ is lager dan de n2, Dus het is onstabieler.
OF2, OF22- I22+
Laten we nu een ander zeer belangrijk molecuul voor het leven zien: moleculaire of diatomeeën zuurstof, of2. Volgens de theorie van Valencia en de structuren van Lewis moet het diamagnetisch zijn; Maar experimenteel is aangetoond dat het paramagnetisch is, dus het is ergens elektronen verdwenen.
Hieronder vergelijken we de OM -diagrammen voor de O2 en ionen of22- (oxide) en O22+ (Oxidicatie):
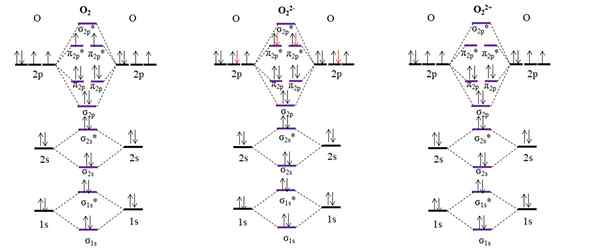 OM -diagrammen voor moleculaire zuurstof en twee van de belangrijkste ionen. Bron: Gabriel Bolívar.
OM -diagrammen voor moleculaire zuurstof en twee van de belangrijkste ionen. Bron: Gabriel Bolívar. Het OM -diagram voor de O2 Monster, in tegenstelling tot de vorige, dat de moleculaire orbitalen σ2 p en π2 p Verander hun energiepositie. We zien ook effectief dat er twee ontbrekende elektronen in de orbitalen zijn π2 p*, waarin het paramagnetische karakter van zuurstof wordt uitgelegd (vermeld aan het begin van het artikel).
Aan de andere kant hebben we ook het OM -diagram voor anion of22-, oneindig verspreid in de kosmos (manen, planeten, kometen, asteroïden, enz.)). Het heeft twee extra elektronen (rode pijlen), die de π -orbitalen afmaken2 p*, alle elektronen paren. Bijgevolg de OK22- Het is diamagnetisch.
We beschouwen ook het OM -diagram voor oxidicatie of22+. Het heeft twee elektronen minder dan de O2, de orbitalen leeg achterlaten π2 p*. Al zijn elektronen zijn gekoppeld en daarom is het diamagnetisch.
Link bestellingen voor de O2, OF22- I22+ Ze zijn respectievelijk: 2 (O = O), 1 [O-O]2- en 3 [O≡O]2+. Daarom de O22+ zou de sterkste link hebben.
Voor-en nadelen
Voordelen
Onder de voordelen van de moleculaire orbitale theorie kunnen we het volgende noemen:
-Het maakt het mogelijk om linkorders te evalueren die gewoon niet veel zin zou hebben in de Valencia Link Theory
-Het correleert goed met diamagnetisme en paramagnetisme van moleculen
-De afstand die moleculaire orbitalen in de diagrammen scheidt, is gelijk aan AE en dient om elektronische overgangenproduct van fotonabsorptie te verklaren
-Geldt niet alleen voor homonucleaire diatomaire moleculen, maar ook voor heteronucleaire moleculen, zoals CO2 en benzeen
-Het breidt zijn model uit naar andere soorten verbindingen, zoals anorganische complexen, dus het ondersteunt de theorie van het veld van liganden
-De overweging dat elektronen in het hele molecuul worden verplaatst, is handig om veel van de fysicochemische eigenschappen te verklaren
Nadelen
En onder enkele van de nadelen van de moleculaire orbitale theorie die we hebben, om te eindigen:
-Het is erg abstract en vereist een diep wiskundig begrip om het volledig te begrijpen
-Moleculatiediagrammen als CO2, CO, H2Of en anderen, ze kunnen te vervelend zijn om uit te werken en uit te leggen
-Hij zegt niets over specifieke regio's of links van een grote molecuul
-Noch biedt het informatie over moleculaire geometrie (trigonaal vlak, vierkant vlak, tetraëdrische, etc.)).
-Het is niet zo grafisch als de link -theorie van Valencia
De moleculaire orbitale theorie is tot slot een theorie die de theorie van de Valencia -link aanvult om een breder en completer panorama van het moleculaire spectrum te hebben.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2020). Orbitale moleculaire theorie. Opgehaald uit: in.Wikipedia.borg
- Stephen lager. (7 september 2020). Orbitale moleculaire theorie. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Steven A. Hardinger. (2017). Orbitale moleculaire theorie. Opgehaald uit: Chemed.Chem.Purdue.Edu
- Persboeken. (S.F.)). Hoofdstuk 8: Orbitale moleculaire theorie. Opgehaald uit: OpenTextbc.AC

