periodiek systeem der elementen
- 4530
- 919
- Hugo Crooks
Wat is het periodiek systeem van de elementen?
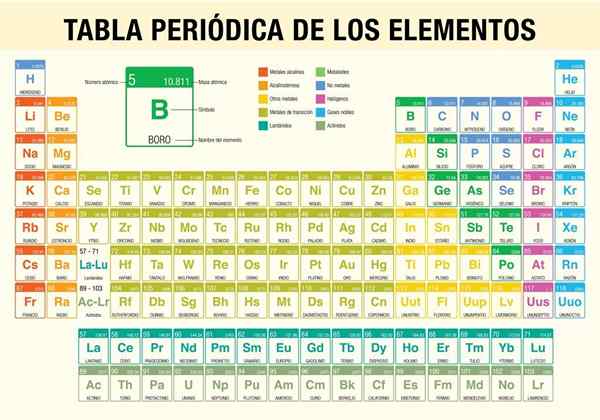
De periodiek systeem der elementen Het is een tool waarmee u de chemische eigenschappen kunt raadplegen van de 118 elementen die tot nu toe bekend zijn. Het is onmisbaar bij het uitvoeren van stoichiometrische berekeningen, het voorspellen van de fysieke eigenschappen van een element, classificeer en het vinden van periodieke eigenschappen bij alle.
Atomen worden zwaarder naarmate hun kernen protonen en neutronen toevoegen, die ook moeten worden vergezeld door nieuwe elektronen; Anders zou elektroneutraliteit niet mogelijk zijn. Sommige atomen zijn dus zeer licht, zoals waterstof, en andere, superpesados, zoals Oganerson.
Het was de wetenschapper Dmitri Mendeléyev, die in 1869 (bijna 150 jaar geleden), na een decennium van theoretische studies en experimenten, de eerste periodieke tabel publiceerde in een poging de 62 elementen te organiseren die op dat moment bekend waren.
Waar is het periodiek systeem voor?
Het belangrijkste gebruik van de tabel zijn:
- Ken het symbool en de naam van elk chemisch element dat bestaat.
- Ken het atomaire massa en het atoomnummer van het element.
- Informeer over de relaties tussen de verschillende elementen.
- Toon de verschillende trends (periodiciteit).
- Classificatie van soorten chemische elementen. Deze typen omvatten alkalische metalen, basismetalen, overgangsmetalen, niet -metalen, edelgassen, halogenen, alkalische landen, semimetalen, actiniden en lanthaniden.
- Voorspel de eigenschappen van nieuwe elementen die nog niet zijn ontdekt of niet gesynthetiseerd.
Hoe wordt het periodiek systeem georganiseerd? (Structuur en organisatie)
Perioden
De elementen worden geordend in rijen of periodes, afhankelijk van het energieniveau van zijn orbitalen. Vóór periode 4, toen de elementen volgden in toenemende volgorde van de atoommassa, was het dat voor elke acht van hen de chemische eigenschappen opnieuw werden herhaald (wet van de octaven, door John Newlands).
Overgangsmetalen sluipen in andere niet -metalen elementen, zoals zwavel en fosfor. Om deze reden was de invoer van kwantumfysica en elektronische configuraties voor het begrip van moderne periodieke tabellen van vitaal belang.
De orbitalen van een energielaag zijn gevuld met elektronen (en de kernen van protonen en neutronen), terwijl deze over een periode beweegt. Deze energielaag gaat hand in hand met atoomgrootte of radio; Daarom zijn de elementen van de hogere perioden kleiner dan die hieronder worden gevonden.
De H en de ik heb gevonden in het eerste (periode) energieniveau; de eerste rij grijze dozen, in de vierde periode; en de rij Ananjadas -dozen, in de zesde periode. Merk op dat, hoewel deze laatste in de vermeende negende periode lijkt te zijn, het eigenlijk tot de zesde behoort, net na de gele doos van BA.
Groepen
Het toeren van een periode is dat de massa, het aantal protonen en elektronen toeneemt. In dezelfde kolom of groep, hoewel de massa en protonen variëren, het aantal van Valencia -laag elektronen is hetzelfde.
In de eerste kolom of groep heeft de H bijvoorbeeld slechts één elektron in de 1s orbital1, Zoals de Li (2s1), Het natrium (3s1), Kalium (4s1) Enzovoort naar de Francio (7s1)). Dat nummer 1 geeft aan dat deze elementen nauwelijks een Valencia -elektron hebben en daarom tot groep 1 (AI) behoren. Elk element is in verschillende perioden.
Zonder waterstof, groene doos te tellen, zijn de elementen eronder uit oranje dozen en worden alkalische metalen genoemd. Een meer naar de rechterbox in elke periode is de groep of kolom 2; dat wil zeggen, zijn elementen hebben twee valentie -elektronen.
Kan u van dienst zijn: theoretische prestatiesMaar wanneer u naar rechts gaat, zonder de kennis van de orbitalen D, bereikt u de Boro (B) of Groep 13 (IIIA) -groep; In plaats van groep 3 (IIIB) of Scandio (SC). Rekening houdend met het vullen van de orbitalen D, worden de perioden van de grijze dozen gereisd: de overgangsmetalen.
Protonen nummers versus elektronen van Valencia
Bij het bestuderen van het periodiek systeem kan de verwarring ontstaan tussen het atoomnummer Z of het aantal totale protonen in de kern en de hoeveelheid valentie -elektronen. Koolstof heeft bijvoorbeeld een z = 6, dat wil zeggen dat het zes protonen heeft en dus zes elektronen (anders kan het geen atoom zijn met neutrale belasting).
Maar van die zes elektronen, Vier komen uit Valencia. Om die reden is de elektronische configuratie [hij] 2s22 p2. [Hij] geeft de twee elektronen 1s aan2 van de gesloten laag, en nemen theoretisch niet deel aan de vorming van chemische links.
Omdat koolstof vier valentie -elektronen heeft, bevindt "handig" zich ook in groep 14 (btw) van het periodiek systeem.
De elementen onder koolstof (ja, GE, SN, PB en FL) hebben meer hogere atomaire (en atomaire) cijfers; Maar iedereen heeft de vier elektronen van Valencia gemeenschappelijk. Dit is de sleutel tot het begrip waarom een element tot de ene groep hoort en niet de andere.
Elementen van het periodiek systeem
Blok s
Zoals uitgelegd, worden groepen 1 en 2 gekenmerkt door een of twee elektronen in orbitalen S te hebben. Deze orbitalen zijn bolvormige geometrie, en omdat een van deze groepen afstammen, verwerven de elementen lagen die de grootte van hun atomen vergroten.
Voor het presenteren van sterke trends in hun chemische eigenschappen en manieren van reageren, zijn deze elementen georganiseerd als blok s. Daarom behoren alkalische metalen en alkalinery -metalen tot dit blok. De elektronische configuratie van de elementen van dit blok is NS (1S, 2s, etc.)).
Hoewel het heliumelement zich rechtsboven in de tabel bevindt, is de elektronische configuratie 1s2 En behoort daarom tot dit blok.
Blok P
In tegenstelling tot blok S, presenteren de elementen van dit blok volledig volledige orbitalen, terwijl hun P -orbitalen zich blijven vullen met elektronen. De elektronische configuraties van de elementen die bij dit blok horen, zijn van het NS -type2NP1-6 (P -orbitalen kunnen een of maximaal zes elektronen hebben om te vullen).
Dus in welk deel van het periodiek systeem is dit blok? Aan de rechterkant: de groene, woning en blauwe dozen; Dat wil zeggen, niet -metalen elementen en zware metalen, zoals bismut (bi) en lood (pb).
Beginnend met Boron, met NS -elektronische configuratie2NP1, Koolstof aan uw rechterkant voegt nog een elektron toe: 2s22 p2. Vervolgens zijn de elektronische configuraties van de andere elementen van periode 2 van blok P: 2s22 p3 (stikstof), 2s22 p4 (zuurstof), 2s22 p5 (fluoride) en 2s22 p6 (neon).
Als de lagere periodes worden verlaagd, hebben de energieniveau 3: 3s23P1-6, Enzovoort tot het einde van blok P.
Merk op dat het belangrijkste in dit blok is dat, in periode 4, de elementen volledig vulde orbitalen hebben (blauwe dozen aan de rechterkant). Samenvattend: het S -blok bevindt zich links van de periodiek systeem en blok P, rechts.
Representatieve elementen
Wat zijn de representatieve elementen? Zij zijn degenen die aan de ene kant gemakkelijk elektronen verliest, of aan de andere kant winnen ze hen om het octet van Valencia te voltooien. Met andere woorden: het zijn de elementen van blokken S en P.
Kan u van dienst zijn: emulgator: emulsieproces, moleculaire aspecten, toepassingenHun groepen onderscheidden zich van anderen door middel van een letter A aan het einde. Er waren dus acht groepen: van AI tot VIIIA. Maar momenteel is het nummeringssysteem dat wordt gebruikt in moderne periodieke tabellen het Arabisch, van 1 tot 18, inclusief overgangsmetalen.
Om die reden kan de Boro -groep de IIIA zijn, of 13 (3+10); de koolstofgroep, btw of 14; en die van de edelgassen, de laatste rechts van de tafel, viiia of 18.
Overgangsmetalen
Overgangsmetalen zijn alle elementen van de grijze dozen. Gedurende hun periodes zijn hun orbitalen gevuld, die vijf zijn en daarom tien elektronen kunnen hebben. Omdat tien elektronen orbitalen moeten invullen, moeten er tien groepen of kolommen zijn.
Elk van deze groepen in het oude nummeringssysteem werd aan het einde aangeduid met Romeinse nummers en een letter B. De eerste groep, die van de Scandio, was de IIIB (3), het ijzer, kobalt en nikkel VIIIB voor zeer vergelijkbare reactiviteiten (8, 9 en 10), en die van zink IIB (12).
Zoals te zien is, is het veel gemakkelijker om groepen op Arabische getallen te herkennen dan Romeinse nummers te gebruiken.
Interne overgangsmetalen
Uit periode 6 van het periodiek systeem beginnen orbitalen F energetisch beschikbaar te zijn. Deze moeten eerst worden gevuld dan de orbitalen D; En daarom worden de elementen meestal uit elkaar geplaatst om de tafel niet te veel uit te breiden.
De laatste twee periodes, oranje en grijsachtig. Er zijn zeven orbitalen F, die veertien elektronen nodig hebben om te vullen, en daarom moeten er veertien groepen zijn.
Als deze groepen aan het periodiek systeem worden toegevoegd, zijn er in totaal 32 (18 + 14) en heeft deze een "langwerpige" versie:
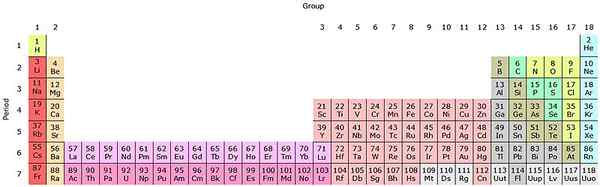 Bron: door Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons
Bron: door Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)], van Wikimedia Commons De heldere roze rij komt overeen met de Lantanoides, terwijl de donkere roze rij de actinoïden. De lantano, de met z = 57, de actinio, ac met z = 89, en het hele blok f behoort tot dezelfde groep van de schandio. Omdat? Omdat de Scandio een orbitaal heeft1, die aanwezig is in de rest van de Lantanoides en actinoïden.
De en AC hebben 5D Valencia -instellingen16s2 en 6d17s2. Terwijl u direct op beide rijen beweegt, beginnen 4F- en 5F -orbitalen te vullen. Eenmaal vol, bereik je de elementen Luthacio, Lu en Laurencio, LR.
Metalen en niet -metalen
Het achterlaten van de cake van het periodiek systeem achter, is het handiger om hun toevlucht te nemen tot die van het superieure beeld, zelfs in zijn langwerpige vorm. Op dit moment waren de overgrote meerderheid van de bovengenoemde elementen metalen.
Bij kamertemperatuur zijn alle metalen vaste stoffen (behalve kwik, die vloeibaar is) van zilvergrijs (behalve koper en goud). Ze zijn meestal ook hard en briljant; Hoewel die van blok s zacht en kwetsbaar zijn. Deze elementen worden gekenmerkt door hun gemak van het verliezen van elektronen en het vormen van kationen m+.
In het geval van de lantanoïden verliezen de drie elektronen 5D16s2 Om drievoudige kationen te worden m3+ (zoals zij3+)). De heuvel kan ondertussen vier elektronen verliezen (CE4+)).
Aan de andere kant vormen niet -metalen elementen het minste deel van het periodiek systeem. Het zijn gassen of vaste stoffen met covalent gekoppelde atomen (zoals zwavel en fosfor). Allen bevinden zich in blok P; Meer precies, in het bovenste deel ervan, omdat het afdalen van de lagere periodes het metalen karakter verhoogt (BI, PB, PO).
Bovendien wint niet -metalen in plaats van elektronen te verliezen, ze. Zo vormen ze anionen x- Met verschillende negatieve belastingen: -1 voor halogenen (groep 17) en -2 voor calcogenen (groep 16, zuurstof).
Kan u van dienst zijn: Ethylalcohol: structuur, eigenschappen, gebruik, verkrijgenMetaalfamilies
Binnen metalen is er een interne classificatie om ze te onderscheiden van:
- Groep 1 metalen zijn alkalisch.
- Groep 2, Alkalinerrior Metals (SR. Scholambara).
- Groep 3 (IIB) Scandio -familie. Deze familie bestaat uit de schandio, groepshoofd, van het ititrium en, van de lantano, actinio en alle lantanoides en actinoides.
- Groep 4 (IVB), Titanium Family: Ti, ZR (Circonium), HF (Hafnio) en RF (Rutherfordio). Hoeveel Valencia -elektronen hebben? Het antwoord staat in uw groep.
- Groep 5 (VB), familie Vanadio. Groep 6 (VIB), Chrome Family. En zo verder naar de zinkfamilie, groep 12 (iib).
Metalloïden
Het metalen karakter neemt van rechts naar links toe, en van boven naar beneden. Maar wat is de grens tussen deze twee soorten chemische elementen? Deze grens bestaat uit elementen die bekend staan als metalloïden, die kenmerken hebben van zowel metalen als niet -metalen.
Metalloïden zijn te zien in het periodiek systeem in de "trap" die begint met boor, en eindigt in het Astato -radioactieve element. Deze elementen zijn:
- B: Boro.
- Silicium: Ja.
- GE: Germanio.
- AS: Arseen.
- SB: Antimoon.
- TE: Telurio.
- AT: Astato.
Elk van deze zeven elementen vertoont tussenliggende eigenschappen, die variëren afhankelijk van de chemische omgeving of temperatuur. Een van deze eigenschappen is halfvorming, dat wil zeggen metalloïden zijn halfgeleiders.
Gassen
Onder aardse omstandigheden zijn gasvormige elementen die niet -lichtmetalen, zoals stikstof, zuurstof en fluor. Ook komen chloor-, waterstof- en edelgassen in deze classificatie. Van al ze zijn de meest emblematische de edelgassen, voor hun lage neiging om te reageren en zich te gedragen als vrije atomen.
De laatste is te vinden in groep 18 van het periodieke tabel en zijn:
- Helio, hij.
- Neon, ne.
- Argon, AR.
- Kripton, KR.
- Xenón, xe.
- Radón, rn.
- En de meest recente van alles, het nobele synthetische oganese gas, OG.
Alle edelgassen hebben gemeen de Valencia NS -configuratie2NP6; dat wil zeggen, ze hebben het octet van Valencia voltooid.
Aggregatietoestanden naar andere temperaturen
De elementen bevinden zich in vaste, vloeibare of gasvormige toestand, afhankelijk van de temperatuur en sterkte van hun interacties. Als de temperatuur van de aarde afkoelt totdat de absolute nul (0k) in de buurt is, zouden alle elementen bevriezen; behalve helium, dat zou condenseren.
Bij deze extreme temperatuur zou de rest van de gassen in de vorm van ijs zijn.
Aan het andere uiterste, als de temperatuur ongeveer 6000k was, zouden "alle" de elementen in een gasvormige toestand zijn. Onder deze omstandigheden konden wolken van goud, zilver, lood en andere metalen letterlijk waargenomen.
Het belang van het periodiek systeem
Momenteel is het periodieke tabel het belangrijkste organisatorische instrument van chemie vanwege de gedetailleerde relaties van haar elementen. Het gebruik ervan is essentieel voor zowel studenten als leraren en voor onderzoekers en veel professionals die zich toeleggen op de tak van chemie en engineering.
Met alleen maar naar het periodieke tabel kijken, worden een enorme hoeveelheid en informatie snel en effectief verkregen, zoals:
- Lithium (Li), Beryllium (BE) en Boron (B) Leden elektriciteit.
- Lithium is een alkalisch metaal, beryllium is een alkalinother metaal en boor is geen metaal.
- Lithium is de beste bestuurder van de drie genoemde, gevolgd door Beryllium en, ten slotte, Boron (halfgeleider).
Door deze elementen in het periodiek systeem te vinden, kan de neiging tot elektrische geleidbaarheid dus onmiddellijk worden afgesloten.