Kwantumtafel
- 3168
- 987
- Dr. Rickey Hudson
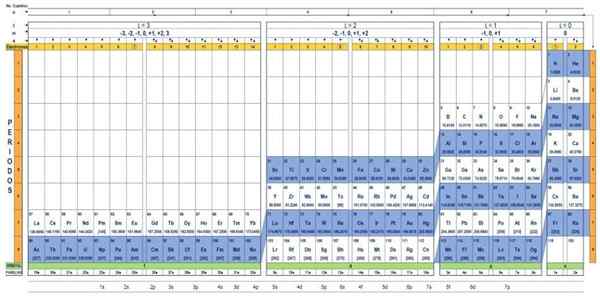
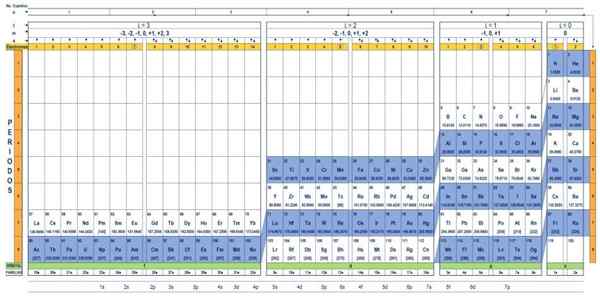 De kwantumtabel van de elementen. Bron: Unam.
De kwantumtabel van de elementen. Bron: Unam. Wat is de kwantumtabel?
De Kwantumtafel Het is een manier om de chemische elementen te organiseren, ontworpen om eenvoudig de set kwantumnummers te bepalen die elk van hen karakteriseren.
Wetenschappers hebben ontdekt dat er in de aard van alle elementen bepaalde patronen zijn. Onder deze patronen zijn kwantumnummers, vier eenvoudige getallen die de elektronische configuratie van elk element beschrijven.
Kwantumaantallen komen op natuurlijke wijze voort uit het mechanisch-mechanische model van het atoom en worden aangeduid met letters: n, ℓ, mℓ en s. Ze beschrijven de energiestatus van elektronen in het atoom van elk chemisch element.
Via de traditionele periodieke tabel en enkele extra tools is het mogelijk om de elektronische configuratie van het atoom van elk element te hebben. Het voordeel van de kwantumtabel is dat de elementen zodanig zijn georganiseerd dat hun kwantumaantallen onmiddellijk zichtbaar zijn, zonder dat ze talloze berekeningen afzonderlijk moeten maken.
Kenmerken van de kwantumtabel
Er zijn verschillende ontwerpen van kwantumtafels. Het model dat in de bovenstaande figuur wordt getoond, bevat:
- Een koptekst met vier rijen, met de waarden van de vier kwantumnummers, N, ℓ, M en S, plus een vijfde rij in geel, die overeenkomt met het aantal elektronen in de buitenste orbital.
- Het lichaam van de tafel, dat bestaat uit een rooster dat het symbool van het chemische element bevat, beginnend met de waterstof, in de voorlaatste kolom van rechts, gevolgd door het helium, enzovoort. Het onderstaande nummer vertegenwoordigt de hoeveelheid atoomelektronen in een fundamentele staat.
- Onderaan, in de groene rij, zijn er vier klassen om de elementen te organiseren: de orbitalen S, P, D en F (van links naar rechts).
- Ten slotte is onder de orbitale rij de familie. Elke kolom is een familie, genummerd van 1 tot 32. 1e en 2e families behoren bijvoorbeeld tot de S -klasse, families van 3e tot 8a, behoren tot klasse P, enzovoort.
Waar is de kwantumtabel voor?
De kwantumtabel dient om de set kwantumnummers te vinden die een elektron uit het atoom karakteriseert. Normaal gesproken zullen deze elektronen die van de buitenste laag zijn, omdat zij degenen zijn die het chemische gedrag van het element definiëren.
Hoe is de kwantumtabel?
De kwantumtabel maakt het mogelijk om eenvoudig de kwantumaantallen van de elektronen in de buitenste laag van de atoom te vinden.
voorbeeld 1
Om de procedure te illustreren, wordt het aluminium -element als een voorbeeld genomen, waarvan het symbool is voor de. De eerste stap is om het in de kwantumtabel te vinden, te markeren met een rode cirkel:
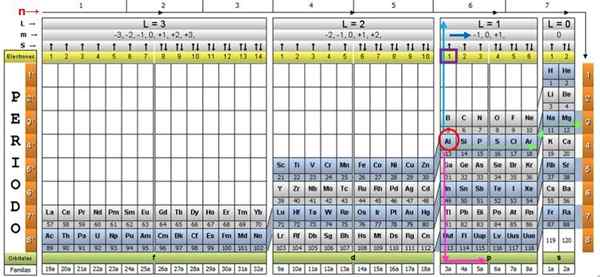
Stap 1: Zoek n
Nadat u het element in de tabel hebt gevonden, moet u door dezelfde rij en kleur naar rechts gaan, totdat u de oranje kolom bereikt, volgens de weg van de groene pijl in de afbeelding.
De pijl wijst naar het gemarkeerde vak met nummer 3, het belangrijkste kwantumnummer n:
n = 3
Stap 2: Zoek ℓ
Om het secundaire kwantumnummer te bepalen, wordt de blauwe verticale pijl gevolgd, wat aangeeft:
ℓ = 1.
Stap 3: Zoek M
Het externe aluminium elektron is te vinden in de pubilling P -familie, zoals kan worden gelezen in de groene rij, waarop de roze pijlpunten.
Bovendien wordt de hoeveelheid elektronen in de laatste laag gelezen in de gele rij van de koptekst. In het geval van aluminium is er 1 elektron (gemarkeerd in het paarse vierkant), wat de referentie is. Door de bovenstaande resultaten te combineren, is de configuratie van de laatste laag:
Kan u van dienst zijn: Galvanic Cell: onderdelen, hoe werkt, toepassingen, voorbeelden3P1
Het is bekend dat een P -laag maximaal 6 elektronen ondersteunt. En het nummer M neemt enkele van de hele waarden - ℓ, ( - ℓ+1), ... 0, ... (+ℓ −1),+ℓ.
Zoals in dit geval ℓ = 1, dan kan M −1, 0, 1 zijn.
Deze nummers verschijnen in de rij van de koptekst die overeenkomt met m (zie in de afbeelding de Horizontale pijl blauw). De volgende tabel dient als een gids om te weten wat de waarde van kiezen is, afhankelijk van de zaak:
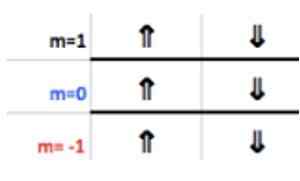
Omdat de laatste aluminiumlaag 1 elektron heeft, komt het magnetische kwantumnummer overeen
M = 1.
Stap 4: Zoek S
Het spinnummer S heeft slechts twee waarden: +½ of - ½. Als de pijl in de bovenkast wordt aangegeven, wordt deze gekozen s = +½ en als deze naar beneden wijst, dan s = - ½. In het geval van aluminium wijst elektron 1 daarom naar boven:
S = + ½.
Kortom, de kwantumaantallen van het elektron van de buitenste laag aluminium voor het geluid:
n = 3; ℓ = 1; M = 1, S = +½
Voorbeeld 2 (uitzonderlijke gevallen)
Silver AG, en ongeveer twintig meer elementen, zijn uitzonderlijke gevallen, dus zorg moet worden besteed bij het gebruik van de kwantumtafel ermee.
Als de vorige procedure wordt herhaald, zou AG worden verkregen als een laatste subniveau op de 4D9.
Dit komt omdat de voorspelde configuratie van La Plata, volgens de regel van Madelung, is:
1s2 2s2 2 p6 3S2 3P6 4S2 3D10 4P6 5s2 4d9
In de praktijk volgt AG deze configuratie echter niet exact, noch andere elementen waarvan de laatste voorspelde laag 4D is9, zoals onder andere koper en goud (raadpleeg internet om een volledige lijst te verkrijgen van elementen die de regel van Madelung niet volgen).
Kan u van dienst zijn: MolealityDe echte configuratie van Ag is:
1s2 2s2 2 p6 3S2 3P6 4S2 3D10 4P6 5s1 4d10
Waarin een elektron van de 5s -laag2 sprong naar de 4D -laag9 Om het te voltooien. Op deze manier neemt de stabiliteit van het atoom toe. Daarom is het laatste sub -niveau echt:
5s1
En de kwantumnummers zouden die zijn die overeenkomen met het RB -element, weergegeven in een paarse doos, met oranje pijlen die naar de resterende getallen wijzen:
n = 5; ℓ = 0; M = 0; S = +½
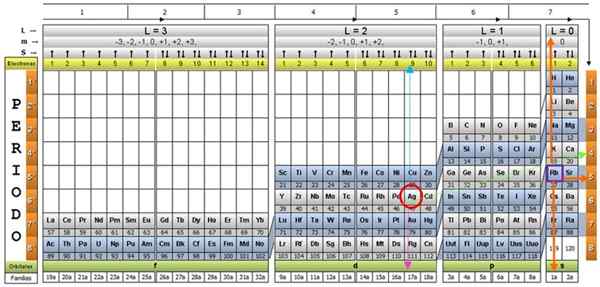 Het beoordelen van het periodieke tabel, in feite wordt gezien dat Ag in periode 5 is, een kenmerk bepaald door het belangrijkste kwantumnummer n.
Het beoordelen van het periodieke tabel, in feite wordt gezien dat Ag in periode 5 is, een kenmerk bepaald door het belangrijkste kwantumnummer n.
Verschillen met het periodiek systeem
Beide tabellen zijn twee manieren om de chemische elementen te organiseren volgens de kenmerken van hun atomen:
-In het periodiek systeem hebben de elementen die in dezelfde kolom worden gevonden vergelijkbare chemische eigenschappen. Het begint bijvoorbeeld met de kolom van de alkalische metalen aan de linkerkant en eindigt die van de edelgassen rechts. Terwijl in de gelederen de elementen zijn met hetzelfde hogere energieniveau.
-De kwantumtabel heeft een getrapte beschikking, ontworpen volgens de vulregels. Daarom moet u de stappen volgen om het belangrijkste kwantumnummer te verkrijgen, behalve in het geval van uitzonderingen zoals zilver, in het voorbeeld van de vorige sectie. De families van elementen in deze tabel zijn gerelateerd via de bovenste orbital, in S, P, D of F.
Referenties
- Chang, R. 2013. Scheikunde. 11VA. Editie. McGraw Hill Education.
- Elektronische configuratie. Elektronische configuratie en kwantumnummers. Opgehaald uit: configUionectronica.com.
- Chemiehandleiding. Opgehaald uit: DCB.engineering.UNAM.mx.
- Officiële chemie. Hoe je kwantumnummers gemakkelijk kunt maken. Opgehaald uit: chemieambtenaar.com
- Triplenlace. Uitzonderingen op de regel van Madelung in de elektronische configuratie van chemische elementen. Opgehaald uit: Triplenlace.com.

