Kopersulfidestructuur, eigenschappen, gebruik

- 3162
- 131
- Aaron Okuneva
Hij kopersulfide Het is een familie van anorganische verbindingen waarvan de algemene chemische formule Cu isXSEn. Ja X Het is groter dan En Het betekent dat dit sulfide rijker is aan koper dan in zwavel; En als daarentegen, X Het is kleiner dan En, Dan is sulfide rijker van zwavel dan in koper.
In de natuur overheersen talloze mineralen die natuurlijke bronnen van deze verbinding vertegenwoordigen. Bijna allemaal zijn rijker van koper dan in zwavel, en hun samenstelling wordt uitgedrukt en vereenvoudigd door de formule metXS; hier X U kunt zelfs fractionele waarden nemen, indicatief voor een stoichiometrische vaste stof (Cu1.75S bijvoorbeeld).
 Een monster van Covellita Mineral, een van de vele natuurlijke bronnen van kopersulfide. Bron: James St. John [CC door 2.0 (https: // creativeCommons.Org/licenties/door/2.0)]
Een monster van Covellita Mineral, een van de vele natuurlijke bronnen van kopersulfide. Bron: James St. John [CC door 2.0 (https: // creativeCommons.Org/licenties/door/2.0)] Hoewel in elementaire toestand de zwavel geel is, zien de afgeleide verbindingen er donkere kleuren uit; Dat komt ook voor bij kopersulfide. Het Covelita -mineraal (superieure beeld), dat voornamelijk uit CUS is samengesteld, vertoont metaalglitter en een blauwachtige iridescentie.
Ze kunnen worden voorbereid uit verschillende koper- en zwavelbronnen, met behulp van verschillende technieken en de syntheseparameters te variëren. U kunt dus Cus nanodeeltjes krijgen met interessante morfologieën.
[TOC]
Kopersulfidestructuur
Links
Deze verbinding lijkt kristallijn te zijn, dus je kunt meteen denken dat het uit cu -ionen bestaat+ (Monovalent koper), Cu2+ (Divalent Copper), S2- E, zelfs, s2- en s22- (disulfur anionen), die interageren via elektrostatische krachten of ionische binding.
Er is echter een licht covalent karakter tussen Cu en S, en daarom kan de Cu-S-link niet worden uitgesloten. Uit deze redenering begint de kristallijne structuur van de CU's (en die van al zijn afgeleide vaste stoffen) te verschillen van die gevonden of gekenmerkt voor andere ionische of covalente verbindingen.
Met andere woorden, er kan niet worden gesproken over pure ionen, maar dat te midden van zijn attracties (kation-anion) een lichte overlapping van zijn externe orbitalen (elektronenuitwisseling) is.
Coördinaties in de covelita
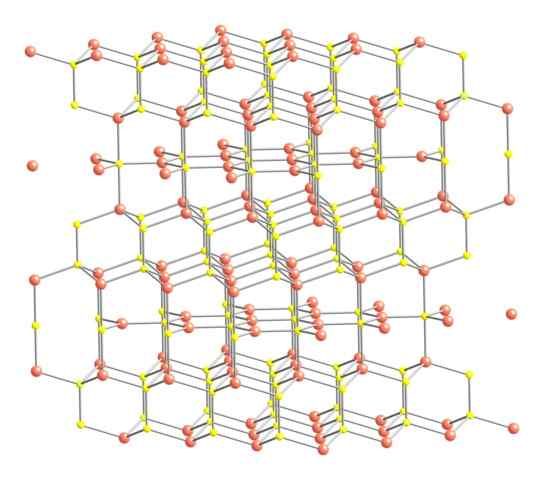 Kristallijne structuur van het Covellita. Bron: Benjah-bmm27 [Public Domain].
Kristallijne structuur van het Covellita. Bron: Benjah-bmm27 [Public Domain]. Dit bovenstaande gezegd, de kristallijne structuur van het coveliet wordt in het beeld weergegeven. Het bestaat uit zeshoekige kristallen (gedefinieerd door de parameters van hun eenheidscellen), waarbij de ionen binden en leiden in verschillende coördinaties; Dit zijn, met een gevarieerd aantal nabijgelegen buren.
Kan u van dienst zijn: Type link van 02In de afbeelding worden koperionen weergegeven met roze bollen, terwijl zwavel met gele bollen.
Als je eerst aandacht richt op roze bollen, zal worden opgemerkt dat sommige worden omgeven door drie gele sferen (trigonale platte coördinatie), en andere voor vier (tetraëdrische coördinatie).
Het eerste type koper, trigonaal, kan worden geïdentificeerd in de vliegtuigen loodrecht op de zeshoekige gezichten die ze geven aan de lezer, waarin ze op hun beurt het tweede type koolstof, tetraëder zijn.
Nu aanwezig naar de gele sferen, hebben sommige vijf roze bollen (trigonale bipyramidecoördinatie), en nog eens drie en een gele bol (opnieuw, tetraëdrische coördinatie); In het laatste is het vóór het disulfide -anion, dat kan worden gevisualiseerd en binnen dezelfde structuur van het coveliet:
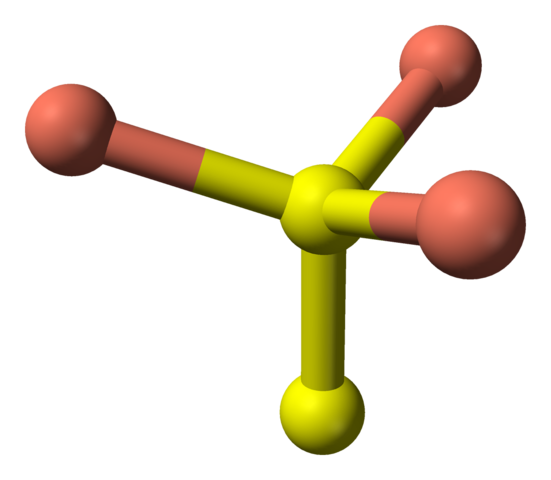 Tetraëdrische coördinatie van het disulfide -anion in het Covellita. Bron: Benjah-bmm27 [Public Domain].
Tetraëdrische coördinatie van het disulfide -anion in het Covellita. Bron: Benjah-bmm27 [Public Domain]. Alternatieve formule
Er zijn dan cu -ionen2+, Cu+, S2- en s22-. Studies uitgevoerd met XPS (XPS) foto -elektronicaspectroscopie wijzen er echter op dat al het koper als kationen is Cu+; En daarom wordt de initiële CUS -formule "beter" uitgedrukt als (cu+))3(S2−) (S2))-.
Merk op dat de relatie cu: s voor de vorige formule 1 blijft 1, en ook de belastingen worden geannuleerd.
Andere kristallen
Een kopersulfide kan ortorrombische kristallen aannemen, zoals in de polymorf, y-cu2S, van de calcocita; Kubiek, zoals in een andere polymorf van calcociet, α-cu2S; Tetragonal, in het Anilita Mineral, Cu1.75S; monoklinic, in de Djurleita, cu1.96S, onder andere.
Voor elk gedefinieerd glas is er een mineraal, en op zijn beurt heeft elk mineraal zijn eigen kenmerken en eigenschappen.
Eigenschappen
Algemeen
De eigenschappen van kopersulfide zijn onderworpen aan de relatie van hun vaste stoffen. Bijvoorbeeld, degenen die anionen presenteren22- Ze hebben zeshoekige structuren en kunnen halfgeleiders of metalen geleiders zijn.
Kan u bedienen: kaliumfosfaat (K3PO4): structuur, eigenschappen, gebruikAls daarentegen het zwavelgehalte bestaat uit anionen2-, Sulfiden gedragen zich als halfgeleiders, en presenteren ook ionische geleidbaarheid bij hoge temperaturen. Dit komt omdat hun ionen beginnen te trillen en in de kristallen bewegen, waardoor elektrische ladingen worden vervoerd.
Optisch, hoewel het ook afhangt van de samenstelling van koper en zwavel, kunnen sulfiden al dan niet straling in het infraroodgebied van het elektromagnetische spectrum absorberen. Deze optische en elektrische eigenschappen maken potentiële materialen die in verschillende apparaten moeten worden geïmplementeerd.
Een andere variabelen om te overwegen, naast de Cu -relatie: S, is de grootte van de kristallen. Het gaat niet alleen over meer "zwavel" of "koperachtige" kopersulfiden, maar de afmetingen van hun kristallen geven een onnauwkeurig effect op hun eigenschappen; Wetenschappers willen dus graag studeren en zoeken naar toepassingen bij nanodeeltjes CuXSEn.
Covelita
Elk mineraal- of kopersulfide heeft unieke eigenschappen. Van allemaal is de covelita echter het meest interessant vanuit een structureel en esthetisch oogpunt (vanwege de irisatie en blauwe tonen). Daarom worden sommige van zijn eigenschappen hieronder genoemd.
Molaire massa
95.611 g/mol.
Dikte
4.76 g/ml.
Smeltpunt
500ºC; Maar het breekt af.
Oplosbaarheid in water
3.3 · 10-5 G/100 ml bij 18ºC.
Toepassingen
Nanodeeltjes in de geneeskunde
Niet alleen varieert de grootte van de deeltjes tot het bereik. Kopersulfide kan dus nanosferen, staven, platen, dunne films, kooien, kabels of buizen vormen.
Deze deeltjes en hun aantrekkelijke morfologieën verwerven individuele toepassingen in verschillende land van geneeskunde.
Nanojaulas of lege bollen kunnen bijvoorbeeld dienen als drugstransporters in het lichaam. Nanosferas zijn gebruikt, ondersteund door koolstofglas en koolstofnanobuisjes, om te dienen als glucosedetectoren; evenals hun aggregaten zijn gevoelig voor biomoleculen detecties zoals DNA.
Het kan u van dienst zijn: 6 natuurlijke pH -indicatoren en hun kenmerkenCus nanobuisjes overschrijden nanosferas bij glucosedetectie. Naast deze biomoleculen zijn immunosensoren ontworpen uit dunne films van CUS en bepaalde ondersteuning voor pathogene detectie.
Nanokristallen en amorfe aggregaten van CU's kunnen zelfs apoptose van kankercellen veroorzaken, zonder schade aan gezonde cellen te veroorzaken.
Nanowetenschap
In de voorste subsectie werd gezegd dat hun nanodeeltjes deel uitmaakten van biosensoren en elektroden. Naast dergelijk gebruik hebben wetenschappers en technici ook gebruik gemaakt van hun eigenschappen om zonnecellen, condensatoren, lithiumbatterijen en katalysatoren te ontwerpen voor zeer specifieke organische reacties; onmisbare elementen in nanowetenschap.
Het is ook vermeldenswaard dat wanneer ze worden ondersteund op geactiveerde koolstof, de NPCUS-CA-set (CA: geactiveerde koolstof en NP: nanodeeltjes) bleek te dienen als een remover van schadelijke kleurstoffen voor mensen en daarom als een zuiveringsinstallatie functioneert Bronnen uit bronnen van waterabsorberende ongewenste moleculen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Kopersulfide. Opgehaald uit: in.Wikipedia.borg
- Ivan Grozdanov en Methodija Najdoski. (negentienvijfennegentig). Optische en elektrische eigenschappen van kopersulfidefilms van variabele samenstelling. Journal of Solid State Chemistry Volume 114, nummer 2, 1 februari 1995, pagina's 469-475. doen.org/10.1006/JSSC.negentienvijfennegentig.1070
- Nationaal centrum voor biotechnologie -informatie. (2019). Kopersulfide (CUS). PubChem -database. CID = 14831. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Peter A. Ajibade en nandipha l. Botha. (2017). Synthese, optische en structurele eigenschappen
- van kopersulfide -nanokristallen van voorlopers met één molecuul. Afdeling Chemie, Universiteit van Fort Hare, Private Bag X1314, Alice 5700, Zuid -Afrika. Nanomaterialen, 7, 32.
- Samenwerking: auteurs en editors van de volumes III/17E-17F-41C (s.F.)). Kopersulfiden (Cu2S, Cu (2-X) S) kristalstructuur, Latice-parameters. In: Madelung of., Rössler u., Schulz M. (eds) Niet-tetraëraal gebonden elementen en binaire verbindingen i. Landolt-Börnstein-Group III gecondenseerde materie (numerieke gegevens en functionele relaties in wetenschap en technologie), Vol 41c. Springer, Berlijn, Heidelberg.
- Momtan, f., Vafaei, a., Ghaedi, m. et al. Koreaanse J. Chem. Eng. (2018). Toepassing van kopersulfide nanodeeltjes geladen geactiveerde koolstof voor gelijktijdige adsorptie van terminale kleurstoffen: responsoppervlakmethodologie. 35: 1108. doen.org/10.1007/S11814-018-0012-1
- Goel, s., Chen, f., & Cai, W. (2014). Synthese en biomedische toepassingen van kopersulfide nanodeeltjes: van sensoren tot theranostiek. Klein (Weinheim An Der Bergstrasse, Duitsland), 10 (4), 631-645. Doi: 10.1002/smll.201301174

