Natriumsulfaat (Na2SO4) structuur, eigenschappen, gebruik, verkrijgen

- 2853
- 325
- Alton D'Amore
Hij sodium sulfaat Het is een anorganisch zout waarvan de chemische formule na is2SW4. Het bestaat uit een witte vaste stof, aanwezig in drie vormen: watervrij, heptohydraat (van weinig bestaan) en Decayroper (die bekend staat als Glaubert -zout); De laatste is de meest voorkomende vorm van natriumsulfaat.
Natriumsulfaat vervallen, NA2SW4· 10h2Of het werd in 1625 ontdekt door Glaubert in het water van een veer, die het Saltabilis (wonderbaarlijk zout) benoemde vanwege zijn medicinale eigenschappen.
 Klokglas met een natriumsulfaatmonster. Bron: Walkerma via Wikipedia.
Klokglas met een natriumsulfaatmonster. Bron: Walkerma via Wikipedia. Natriumsulfaat heeft talloze toepassingen in de textiel- en papierindustrie, evenals in de productie van glas. Het gebruik ervan wordt uitgebreid met thermische toepassingen, waaronder de omgevingsvoorziening van warmte en het koelen van laptops.
Natriumsulfaat is een verbinding van lage toxiciteit en zijn schadelijke acties, ze zijn fundamenteel mechanisch en niet -chemisch. Om kristallografische redenen is dit zout, net als zijn poëtassium tegenhanger, k2SW4, presenteert framework en polymorfe structuren.
[TOC]
Structuur
Watervrij zout
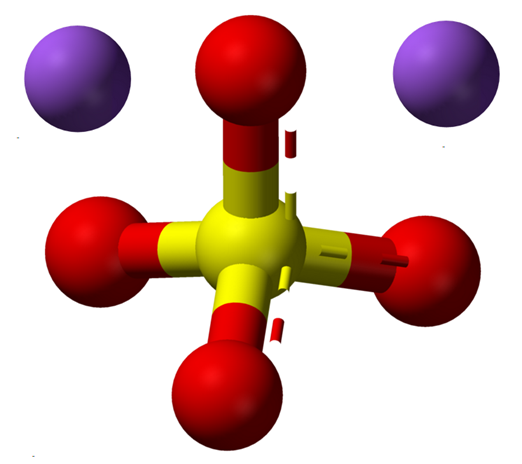 Watervrij natriumsulfaationen ionen. Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Watervrij natriumsulfaationen ionen. Bron: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] De NA -formule2SW4 Geeft eenmaal de naionen in zoutkristallen aan+ En dus42- Ze hebben een relatie van 1: 2; dat wil zeggen, voor elke twee kationen na+ Er is dus een anion42- Interactie met hen door elektrostatische aantrekkingskracht (superieure afbeelding).
Dit geldt natuurlijk voor de NA2SW4 watervrij, zonder watermoleculen gecoördineerd met natrium in de kristallen.
 Sodium sulfaat
Sodium sulfaat Ondanks dat het een eenvoudig uiterlijk is, is de beschrijving structureel complex. Dan een2SW4 Het presenteert polymorfisme, met maximaal vijf kristallijne fasen: I, II, III, IV en V, wiens overgangstemperaturen respectievelijk 180, 200, 228, 235 en 883 ºC zijn.
Hoewel er geen referenties zijn die het certificeren, de NA2SW4Ik moet degene zijn die een zeshoekige kristallijne structuur heeft, dichter in vergelijking met de Na Ortorrombic2SW4Iii, in wiens kristallen de NA+ Tetrahedra -vorm (nao4) en octaëder (Nao6) coördinatie; dat wil zeggen, het kan dus worden omgeven door vier of zes anionen42-.
Rottendratada zout
Ondertussen is de monokliene kristallijne structuur van zijn belangrijkste hydraat, NA2SW4· 10h2Of het is eenvoudiger. Daarin zijn het praktisch de watermoleculen die interageren of coördineren met de NA+ In de octaëder na (h2OF)6+, Met de SO42- nauwelijks voldoende stabiliteit bijdragen aan het glas om in een vaste fase te bestaan.
Het kan u van dienst zijn: eerste chemie -revolutieHet smeltpunt (32,38 ºC) veel lager dan dat van watervrijzout (884 ºC) toont echter hoe watermoleculen en hun waterstofbruggen de ionische interacties, sterker, in NA verzwakken2SW4.
Eigenschappen
Namen
-Natriumsulfaat (IUPAC)
-Glauber zout (uitdrogen)
-Sala Miraculous (Decayroper)
-Disatriumsulfaat.
Molaire massa
142.04 g/mol (Anh¡dro)
322.20 g/mol (dechydraat)
Fysiek uiterlijk
Witte hygroscopische kristallijne vaste stof
Geur
Toilet
Smaak
Bitter en zout
Dikte
2.664 g/cm3 (watervrij)
1,464 g/cm3 (Dahydraat)
Merk op hoe watermoleculen in de kristallen ervoor zorgen dat ze verwijden en daarom hun dichtheid verminderen.
Smeltpunt
884 ºC (watervrij)
32.38 ºC (dechydraat)
Kookpunt
1.429 ºC (watervrij)
Oplosbaarheid in water
4.76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42.7 g/100 ml (100 ºC)
Alle oplosbaarheidswaarden komen overeen met watervrijzout, dat vrij oplosbaar is in water bij alle temperaturen.
De oplosbaarheid neemt abrupt toe tussen 0 ºC en 38,34 ºC, waarmee wordt opgemerkt dat de oplosbaarheid in dit bereik van temperaturen meer dan 10 keer toeneemt. Van de oplosbaarheid van 32,38 ºC is echter onafhankelijk van de temperatuur.
Het gebeurt dat bij temperatuur 32,8 ºC het vervalde natriumsulfaat oplost in zijn eigen kristallijne water. Daarom is een evenwicht tussen rottend zout, anhydra -zout en de verzadigde oplossing van natriumsulfaat.
Zolang de drie -fasenconditie wordt gehandhaafd, blijft de temperatuur constant, waardoor de temperatuur van de thermometers kan kalibreren.
Aan de andere kant zijn de oplosbaarheid voor heptahydraat zout:
19,5 g/100 ml (0 ºC)
44.0 g/100 ml (20 ºC)
Merk op dat bij 20 ° C het heptahydraatzout drie keer meer oplosbaar is dan watervrij.
Brekingsindex
1.468 (watervrij)
1.394 (dechydraat)
Stabiliteit
Stabiel onder aanbevolen opslagomstandigheden. Onverenigbaar met sterke zuren en basen, aluminium en magnesium.
Ontleding
Wanneer het wordt verwarmd tot ontleding, straalt het een giftige rook van zwaveloxide en natriumoxide uit.
pH
Een waterige oplossing van 5 % heeft een pH van 7.
Reactiviteit
Natriumsulfaat dissocieert in waterige oplossing in 2 na+ En dus42-, waardoor het sulfaation kan worden gecombineerd met de BA2+ Om bariumsulfaat neer te slaan. Het helpt praktisch om de bariumionen van watermonsters te verplaatsen.
Kan u van dienst zijn: transaminatieNatriumsulfaat wordt natriumsulfide door reactie bij hoge temperaturen met steenkool:
NA2SW4 + 2 C => NA2S +2 CO2
Glaubert's Salt, Naso4.10h2O reageert met kaliumcarbonaat om natriumcarbonaat te produceren.
Toepassingen
Papierindustrie
Natriumsulfaat wordt gebruikt in de productie van papieren pulp. Het wordt gebruikt bij de uitwerking van kraftpapier, dat geen lignine bevat of zich onderwerpt aan het bleekproces, reden die het een grote weerstand geeft. Bovendien wordt het gebruikt in kartonnen productie.
Wasmiddelen
Het wordt gebruikt als synthetisch wasmiddelvulmateriaal voor gebruik thuis, wat toevoegt aan wasmiddel om de oppervlaktespanning te verminderen.
Glas
Het wordt gebruikt in de productie van glas om de aanwezigheid van kleine luchtbellen in gesmolten glas te verminderen of te elimineren. Bovendien elimineert Slag -vorming tijdens het raffinageproces van gesmolten glas.
Textielindustrie
Natriumsulfaat wordt gebruikt als een mordant, omdat het de interactie van kleurstoffen met stofvezels vergemakkelijkt. Detahydrated natriumsulfaat wordt gebruikt in de kleurstoftest.
Bovendien wordt natriumsulfaat gebruikt als een kleurstofverdunning en extra kleurstofdrukmiddel; zoals directe kleurstoffen, zwavelkleurstoffen en andere middelen die de voorkeur geven aan katoenvlekken. Het wordt ook gebruikt als een agent dat de directe kleurstoffen van zijde vertraagt.
Geneesmiddel
Decahrid natriumsulfaat wordt gebruikt als een laxeermiddel, omdat het weinig wordt geabsorbeerd in de darm en daarom blijft in het licht hiervan en een toename van het volume veroorzaakt. Dit stimuleert de toename van peristaltische contracties die de verdrijving van het darmgehalte induceren.
Natriumsulfaat is een tegengif om vergiftiging met barium en loodzouten te beheersen. Glaubert -zout is effectief voor de eliminatie van bepaalde medicijnen die overmatig ingenomen zijn; Bijvoorbeeld paracetamol (acetoaminophen).
Bovendien wordt het gebruikt om slechte elektrolyten te leveren met aanwezigheid in isoosmotische oplossingen.
Droogmiddel
Natriumsulfaat omdat het een inerte reagens is, wordt gebruikt voor het verwijderen van water uit organische samengestelde oplossingen.
Grondstof
Natriumsulfaat wordt gebruikt als grondstof voor de productie van talloze stoffen, waaronder: natriumsulfide, natriumcarbonaat en ammoniumsulfaat.
Kan u van dienst zijn: gaschromatografieHet verkrijgen van
Natriumsulfaat wordt verkregen door mijnwedstrijd en chemische reacties.
Mijnbouwextractie
Er zijn drie erts of mineralen die worden benut met commerciële prestaties: Thanardita (NA2SW4), Mirabilita (Na2SW4· 10h2O) en de Glaubarita (NA2SW4·Geval4)).
In Spanje worden de afzettingen van Thenardita en Mirabilita benut door ondergrondse mijnbouw van galerijen en pilaren. Ondertussen wordt de Glauberita in de open lucht verkregen door grote vlotten die op de minerale tank worden geplaatst.
Het terrein wordt bereid met lage intensiteitsstralen om een porositeit te produceren waardoor natriumsulfaat uitloging mogelijk is. De productiefase treedt op met sprinklerirrigatie met zoet water uit de Glauberita, wiens uitloging zich op een dalende manier voortplant.
De natriumsulfaatpekel wordt verzameld, waarbij het calciumsulfaatresidu wordt gevuld.
Chemische productie
Natriumsulfaat wordt verkregen tijdens de productie van zoutzuur door twee processen: het Mannheim -proces en het hardgrenave -proces.
Mannheim -proces
Het wordt gedaan in grote stalen ovens en met een 6 m stalen reactieplatform. De reactie treedt op tussen natriumchloride en zwavelzuur:
2 NaCl +H2SW4 => 2 HCl +NA2SW4
Hardreave -proces
Het gaat om de reactie van natriumchloride, zwaveloxide, zuurstof en water:
4 NaCl + 2 Dus2 + OF2 + 2 H2O => 4 HCl +NA2SW4
Anderen
Natriumsulfaat treedt op bij de neutralisatiereactie tussen natriumhydroxide en zwavelzuur:
2 NaOH +H2SW4 => NA2SW4 + H2OF
Natriumsulfaat is een bijproduct van de productie van talloze verbindingen. Het wordt geëxtraheerd uit het vloeibare afval dat wordt geloosd tijdens de productie van de viscose en het cellofaan. Ook bij de productie van natriumdichromaat, fenolen, boorzuur en lithiumcarbamaat.
Risico's
Natriumsulfaat wordt beschouwd als een verbinding met lage toxiciteit. Het kan echter enige schade veroorzaken aan de persoon die het ongepast gebruikt.
U kunt bijvoorbeeld oogirritatie, roodheid en pijn veroorzaken. In de huid kan het bij sommige mensen irritatie en allergie veroorzaken. De inname kan irritatie van het spijsverteringskanaal veroorzaken met misselijkheid, braken en diarree. En ten slotte, de inademing ervan veroorzaakt irritatie in de luchtwegen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Sodium sulfaat. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2019). Sodium sulfaat. PubChem -database. CID = 24436. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- B. N. Mehrotra. (1978). De kristalstructuur van NA2SW4III. Hersteld van: rruff-2.geo-.Arizona.Edu
- Glauberita-Thenardita (natriumsulfaat). [PDF]. Hersteld van: igme.is
- « Zinkoxide (ZnO) structuur, eigenschappen, gebruik, risico's
- Lactofenol blauwe kenmerken, samenstelling, voorbereiding, gebruik »

