Succinato dehydrogenase structuur, functie, regulatie, ziekten
- 2102
- 216
- Nathan Wiegand
SUccinato dehydrogenase ((SDH), ook bekend als de complex II van de elektrontransportketen, is het een mitochondriaal eiwitcomplex met enzymatische activiteit die zowel in Krebs -cyclus als in de elektronentransportieketen (cel ademhaling) werkt).
Het is een enzym dat aanwezig is in alle aerobe cellen. In eukaryoten is het een complex dat nauw geassocieerd is met het interne mitochondriale membraan, terwijl het in de prokaryoten wordt gevonden in het plasmamembraan.
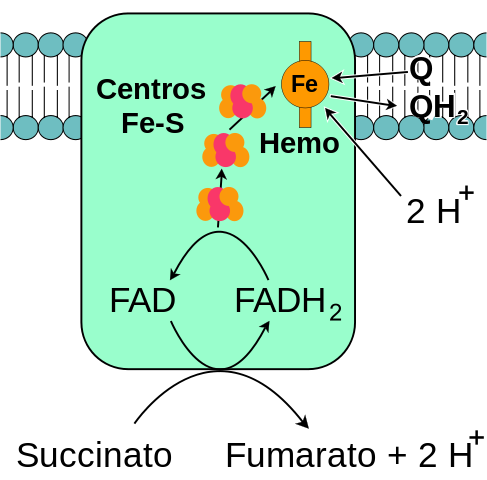 Algemeen schema van het mitochondriale complex Succinaatdehydrogenase (bron: ikzelf, gebaseerd op fvasconcellos vectorisatie. / Public Domain, via Wikimedia Commons)
Algemeen schema van het mitochondriale complex Succinaatdehydrogenase (bron: ikzelf, gebaseerd op fvasconcellos vectorisatie. / Public Domain, via Wikimedia Commons) De complexe succinaatdehydrogenase, rond 1910 ontdekt en voor het eerst gezuiverd in 1954 door Singer en Kearney, is om verschillende redenen uitgebreid bestudeerd:
- Het werkt zowel in de Krebs -cyclus (citroenzuurcyclus of tricarbonzuurcyclus) als in de elektronentransportketen (katalyseert de oxidatie van succes tot fumaraat)
- Zijn activiteit wordt gereguleerd door verschillende activatoren en remmers en
- Het is een complex geassocieerd met: ijzer die niet is gekoppeld aan een hemobroep, labylzwavel en dyucleotiden van Flavina Adenina (FAD)
Het wordt gecodeerd door het nucleaire genoom en het is bewezen dat mutaties in de vier genen die elk van zijn subeenheden codificeren (A, B, C en D) resulteren in verschillende klinische afbeeldingen, dat wil zeggen dat ze vanaf het punt behoorlijk negatief kunnen zijn van het oog op de fysieke integriteit van mensen.
[TOC]
Structuur
Het enzymcomplex succinaatdehydrogenase wordt gevormd door vier subeenheden (heterotarámero) gecodeerd door het nucleaire genoom, dus het is het enige complex van oxidatieve fosforylering in de elektronentransportketen die geen subeenheid heeft gecodeerd door het mitochondriale genoom.
Bovendien is dit complex de enige die geen protonen door het interne mitochondriale membraan pompt tijdens zijn katalytische werking.
Volgens studies op basis van het enzymatische complex van varkenshartcellen, bestaat het complexe succinaatdehydrogenase uit:
- A "hoofd" Hydrofiel die zich uitstrekt van het interne mitochondriale membraan tot de mitochondriale matrix en
- A "lijn" Hydrofoob die is ingebed in het interne mitochondriale membraan en dat heeft een klein segment dat wordt geprojecteerd op de oplosbare intermembraanruimte van de mitochondria
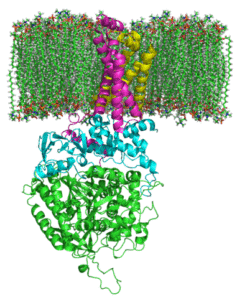 Structuur van de complexe succinaatdehydrogenase (Bron: Zephyris bij de Engelse taal Wikipedia/CC BY-SA (http: // creativeCommons.Org/licenties/by-sa/3.0/) Via Wikimedia Commons)
Structuur van de complexe succinaatdehydrogenase (Bron: Zephyris bij de Engelse taal Wikipedia/CC BY-SA (http: // creativeCommons.Org/licenties/by-sa/3.0/) Via Wikimedia Commons) Hydrofiele deelstructuur
De hydrofiele kop is samengesteld uit de SDHA (70 kDa) en SDHB (27 kDa) (SDH1 en SDH2 in gisten) en dit omvat het katalytische centrum van het complex.
SDHA- en SDHB -subeenheden bevatten redox -cofactoren die deelnemen aan de overdracht van elektronen naar het ubiquinon (co -enzym Q10, een molecuul dat elektronen transporteert tussen ademhalingscomplexen I, II en III).
De SDHA-subeenheid heeft een fad-cofactor (een co-enzym dat deelneemt aan oxide-reductiereacties) samen met zijn structuur, alleen op de plaats van kruising voor succinaat (het hoofdsubstraat van het enzym).
De SDHB-subeenheid heeft 3 ijzer-suikercentra (Fe-S) die de overdracht van elektronen naar de ubiquinon bemiddelen. Een van de centra, 2Fe-2s, bevindt zich in de buurt.
Kan u van dienst zijn: fylogenieOpgemerkt moet worden dat structurele studies aangeven dat SDHB -subeenheid het interface vormt tussen het hydrofiele katalytische domein en het domein van "anker" van het membraan (hydrofoob) van het complex.
Hydrofobe deelstructuur
Het membranale domein van het complex, zoals vermeld, bestaat uit de SDHC (15 kDa) en SDHD (12-13 kDa) (SDH3 en SDH4 in gisten), die uitgebreide membraaneiwitten zijn gevormd, elk, door 3 transmembranale propellers.
Dit domein bevat een Hemo -gedeelte B samengevoegd in de interface tussen de SDHC- en SDHD -subeenheden, waarbij elk van de twee histidine liganden die ze bij elkaar houden.
In dit enzym zijn twee vakbondslocaties voor Ubiquinona gedetecteerd: een van de grote affiniteit en een van lage affiniteit.
De site met hoge affiniteit, bekend als QP (P door proximaal) Het is gezicht voor de mitochondriale matrix en wordt gevormd door specifieke aminozuurresiduen in de SDHB-, SDHC- en SDHD -subeenheden.
De site met lage affiniteit, ook wel genoemd QD (D door distaal) Het is, in het deel van het interne mitochondriale membraan waar het complex wordt ingebracht, dichter bij de intermembraanruimte, dat wil zeggen verder van de organelmatrix.
Samen heeft het totale complex een molecuulgewicht in de buurt van 200 kDa en is vastgesteld dat het een verhouding van 4 heeft.2-5.0 Flavin-nanomolen per milligram eiwit en 2-4 g ijzer voor elke mol flavina.
Functie
Het enzymatische succinaatcomplex dehydrogenase vervult een belangrijke functie in de mitochondriën, omdat niet alleen deelneemt aan de Krebs -cyclus (waar het deelneemt aan de afbraak van acetyl -CoA), maar ook onderdeel van de ademhalingsketen, fundamenteel voor ATP -vormige energieproductie.
Met andere woorden, het is een belangrijk enzym voor intermediair metabolisme en ATP -aerobe productie.
- Het is verantwoordelijk voor de oxidatie van de succinaat tot fumaraat in de citroenzuurcyclus
- Het voedt de complex III van de elektronentransporteur met de elektronen afgeleid van de oxidatie van de succinaat, die helpt zuurstof te verminderen en water te vormen
- Elektrontransport genereert een elektrochemische gradiënt door het interne mitochondriale membraan, dat ATP -synthese bevordert
Als alternatief kunnen elektronen worden gebruikt om moleculen uit een "pool" van ubiquinonas te verminderen, waardoor de benodigde reductoren worden geproduceerd om superoxide -anionen te verminderen die afkomstig zijn van dezelfde ademhalingsketen of die afkomstig zijn van exogene bronnen.
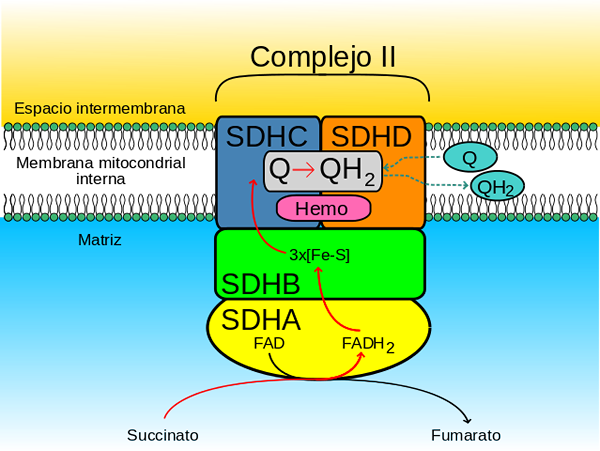 Succinaat complexe degidrogenasa (Bron: JohnHFST / Public Domain, via Wikimedia Commons)
Succinaat complexe degidrogenasa (Bron: JohnHFST / Public Domain, via Wikimedia Commons) Hoe handelt het?
De subeenheid A van het complex (dat covalent is gekoppeld aan de rage co -enzym) sluit zich aan bij de substraten, fumaraat en succinaat, evenals zijn fysiologische regulatoren, oxalacetaat (competitieve remmer) en ATP.
De ATP verplaatst de unie tussen oxalacetaat en het SDH -complex en dan worden de elektronen die "voorbij" zijn van de succinaat naar de SDHA -subeenheid overgebracht naar de groepen ijzer- en zwavelatomen die aanwezig zijn in de SDHB -subeenheid door middel van de Coenzyme FAD.
Kan u van dienst zijn: myosine: kenmerken, structuur, typen en functieVanaf subeenheid B bereiken deze elektronen de Hemo -plaatsen B van de SDHC- en SDHD -subeenheden, vanwaar ze worden "geleverd" aan Quinonas Coenzymen via hun vakbondslocaties naar Quinonas.
De elektronische stroom van de succinaat door deze transporters en zelfs de uiteindelijke acceptor, die zuurstof is, is gekoppeld aan de synthese van 1.5 ATP -moleculen voor elk elektronisch koppel door fosforylering van de ademhalingsketen.
Inzima -defecten
Er is gemeld dat mutaties in het gen dat codeert voor de subeenheid A van het complexe succinaatdehydrogenase encefalopathieën kunnen veroorzaken tijdens de kindertijd, ondertussen zijn de mutaties in de genen die coderen voor subeenheden B, C en D geassocieerd met de vorming van tumoren.
Regulatie
De activiteit van de complexe succinaatdehydrogenase kan worden gereguleerd door post -translationele modificaties zoals de fosforylering en de acetylering, Hoewel de remming van actieve locaties ook kan optreden.
Acetylering van sommige lysineverval kan de activiteit van dit enzym verminderen en dit proces wordt uitgevoerd door een enzym van acetylase dat bekend staat als SIRT3; Fosforylering heeft hetzelfde effect op het enzym.
Naast deze wijzigingen wordt het SDH -complex ook gereguleerd door intermediairs van de Krebs -cyclus, met name de Oxalacetaat en de opvolgen. Oxalacetaat is een krachtige remmer, terwijl succinaat de dissociatie van oxalacetaat bevordert, die als een activator functioneert.
Impulcinatedeficiëntie dehydrogenase
Het succinaat -deficiëntie dehydrogenase is een anomalie of mitochondriale ademhalingsketenstoornis. Dit tekort wordt veroorzaakt door SDHA (of SDHAF1), SDHB-, SDHC- en SDHD -mutaties.
Verschillende onderzoeken hebben homozygote en heterozygote mutaties in deze genen aangetoond, vooral SDHA. De mutaties van deze genen veroorzaken aminozuursubstituties in het eiwit (in een van de SDHA, B, C of D), of falen die abnormaal korte eiwitten codificeren.
Daarom geven aminozuursubstituties en abnormaal korte eiwitcodering, aanleiding geven tot aandoeningen of veranderingen van het SDH -enzym, die een falen veroorzaken in de optimale capaciteit van mitochondria om energie te produceren. Dit is wat wetenschappers noemen als mitochondriale ademhalingsketenstoornis.
Deze aandoening kan op veel manieren fenotypisch in de mens worden uitgedrukt. De bekendste zijn: deficiëntie of gebrek aan taalkundige ontwikkeling, spastische quadruplex, onvrijwillige spiercontracties (dystonie), spierzwakte en myocardiopathie, onder andere gerelateerde problemen.
Sommige patiënten met succinaat-deficiëntie dehydrogenase kunnen de ziekte van Leight of Kearns-Saire-syndroom manifesteren.
Hoe wordt gedetecteerd gedetecteerd dehydrogeneerde succinaatdeficiëntie?
Bepaalde studies suggereren het gebruik van kwalitatieve tests en analyse, evenals kwantitatieve, enzymatische, ademhalingsketen biochemische analyse. Anderen daarentegen suggereren de volledige expansie door de polymerasekettingreactie (PCR) van de exons van de onderzochte subeenheden en vervolgens de respectieve sequencing.
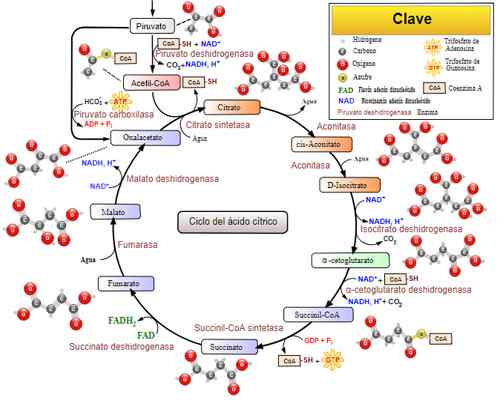 Tricarbonzuurcyclus (Krebs -cyclus). Genomen en bewerkt uit: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (vertaald in het Spaans door Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)].
Tricarbonzuurcyclus (Krebs -cyclus). Genomen en bewerkt uit: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (vertaald in het Spaans door Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]. Gerelateerde ziekten
Er zijn veel fenotypische uitdrukkingen geproduceerd door mitochondriale ademhalingsketenstoornissen, als gevolg van succinaat -deficiëntie dehydrogenase. Als het echter gaat om syndromen of ziekten, is er sprake van het volgende.
Kan u van dienst zijn: de 8 belangrijkste biogeochemische cycli (beschrijving)Leight syndroom
Het is een progressieve neurologische ziekte, geassocieerd met mutaties in het nucleaire genoom (in dit geval van dehydrogenase-succinaat), die het pyruvaat-dishydrogenase-complex beïnvloeden tot de oxidatieve fosforyleringsroute.
De symptomen verschijnen vóór het eerste jaar van het individu, maar in atypische gevallen zijn de eerste symptomen tijdens de adolescentie waargenomen.
Een van de meest waargenomen symptomen zijn: hypotonie met verlies van cefalische controle, onvrijwillige bewegingen, recidiverend braken, ademhalingsproblemen, onvermogen om de oculaire bloedcellen, piramide en extrapiramidale tekens onder andere te verplaatsen. Epilaties zijn niet erg gebruikelijk.
Het is mogelijk dat de ziekte kan worden gedetecteerd in prenatale diagnoses. Een specifieke remedie of behandeling is niet bekend, maar sommige specialisten suggereren behandelingen met bepaalde vitamine of cofactors.
Gastro -intestinale stroma -tumor (GIST)
Gewoonlijk gist genoemd, het is een type maagdarmkanaaltumor, die zich in het algemeen ontwikkelt in gebieden zoals maag of dunne darm. Er wordt aangenomen dat de oorzaak hiervan te wijten is aan een bepaalde groep zeer gespecialiseerde cellen genaamd ICC -cellen of interstitiële cellen van Cajal.
Andere overwegingen over de oorzaak van GIST zijn de mutaties van bepaalde soorten genen, die volgens sommige auteurs 90% van de tumoren veroorzaken. De betrokken genen zijn: Kit, PDGFRA -genen, dehydrogenase succinaat (SDH) - arm.
De succinaatdehydrogenase (SDH) - Slecht komt voornamelijk voor bij jonge vrouwen, produceert maagtumoren en produceert met relatieve frequentie metastasen in lymfeklieren. Een klein percentage treedt op bij kinderen en in de meeste gevallen is het te wijten aan het gebrek aan uitdrukking van de SDHB -subeenheid.
Kearns-Sayre-syndroom
Er is vastgesteld dat sommige patiënten met succinaat dehydrogenase-tekortkomingen het Kearns-Sayre-syndroom kunnen manifesteren. Deze ziekte is gerelateerd aan mitochondriale aandoeningen en wordt gekenmerkt door de afwezigheid van beweging van oculaire ballonnen.
Andere kenmerken van deze ziekte zijn pigmentretinitis, doofheid, cardiomyopathie en aandoeningen van het centrale zenuwstelsel. Meestal worden deze symptomen waargenomen voordat de patiënt 20 jaar oud wordt. Er is geen prenatale diagnose voor deze aandoening bekend.
Noch is genezing voor deze ziekte. De behandeling is palliatief, dat wil zeggen, het werkt alleen om de effecten van de ziekte te verminderen, niet de remedie. Aan de andere kant, hoewel het afhangt van het aantal getroffen organen en de ontvangen medische zorg, is de levensverwachting relatief normaal.
Referenties
- Ackrell, B. NAAR., Kearney, E. B., & Singer, T. P. (1978). [47] zoogdier succinaat dehydrogenase. In methoden in enzymologie (vol. 53, PP. 466-483). Academische pers.
- Brère, J. J., Favier, J., GHOUZZI, V. EN., Djoudi, f., Benit, p., Gimenez, a. P., & Rustin, p. (2005). Succinaat dehydrogenase -tekortkoming bij de mens. Cellulaire en moleculaire levenswetenschappen CMLS, 62 (19-20), 2317-2324.
- Cecchini, g., Schröder, ik., Gunalus, r. P., & Maklashina, en. (2002). Succinaat dehydrogenase en fumerate redactase van Escherichia coli. Biochimica et Biophysica Acta (BBA) -BiEenergetics, 1553 (1-2), 140-157.
- Hatefi, en., & Davis, K. NAAR. (1971). Succinaat dehydrogenase. Je. Zuivering, moleculaire eigenschappen en substructuur. Biochemistry, 10 (13), 2509-2516.
- Hederstedt, l. NAAR. R. S., & Rutberg, l. NAAR. R. S. (1981). Succinaat dehydrogenase-a vergelijkende beoordeling. Microbiologische beoordelingen, 45 (4), 542.
- Nelson, D. L., Lehninger, een. L., & Cox, m. M. (2008). Lehninger -principes van biochemie. Macmillan.
- Rutter, J., Winge, D. R., & Schiffman, J. D. (2010). Succinaat dehydrogenase-asembly, regulatie en rol in menselijke diew. Mithochondrion, 10 (4), 393-401.
- « Essentiële vetzuren functies, belang, nomenclatuur, voorbeelden
- Regel T -functies, zodat het serveert, voorbeelden »

