Esters
- 2991
- 690
- Lonnie Rohan
 Esteres zijn organische verbindingen die een component van carbonzuur en een andere alcohol hebben
Esteres zijn organische verbindingen die een component van carbonzuur en een andere alcohol hebben Wat zijn esters?
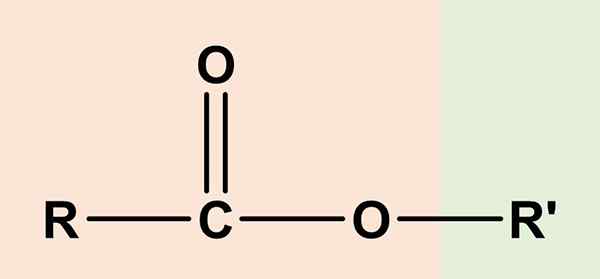
De esters Het zijn organische verbindingen met een carbonzuurcomponent en een andere alcohol. De algemene chemische formule is RCO2R' of RCOor'. De rechterkant, RCOO, komt overeen met de carboxylgroep, terwijl de rechterkant, of' Het is alcohol. De twee delen een zuurstofatoom en delen een bepaalde gelijkenis met de ethers (ror ').
Om deze reden het acetaat van ethyl, ch3Cooch2Ch3, De eenvoudigste esters, werd beschouwd als de Azijnzuur of azijnzuur ether, En van daaruit de etymologische oorsprong van de naam 'Ester'. Zodat een ester bestaat uit de vervanging van de zure waterstof van de COOH -groep, met een alcoholhuur van een alcohol.
Waar zijn de esters?
Uit de bodem van organische chemie zijn er veel natuurlijke bronnen. De aangename geur van fruit, zoals bananen, peren en appels, is het product van de interactie van esters met vele andere componenten. Ze worden ook gevonden in de vorm van triglyceriden in oliën of vetten.
Ons lichaam produceert triglyceriden uit vetzuren, die lange koolzuurhoudende ketens hebben, en glycerolalcohol. Wat sommige esters van anderen onderscheidt, ligt zowel in R, de keten van de zuurcomponent, zoals in R ', die van de alcoholische component.
Een ester met een laag molecuulgewicht moet weinig koolstofatomen hebben in R en R ', terwijl anderen, zoals wassen, veel koolstofatomen hebben, vooral in R', de alcoholische component en dus hoge molecuulgewichten.
Niet alle esters zijn echter strikt organisch. Als het carbonhel -groepsatoom van de carbonylgroep wordt vervangen door een van fosfor, dan zal rpoor hebben '. Dit staat bekend als een fosfaatester en is cruciaal belang in de structuur van DNA.
Dus wanneer een atoom efficiënt kan worden gekoppeld aan koolstof of zuurstof, zoals zwavel (rsoor '), kan het daarom een anorganische ester vormen.
Estres eigenschappen
Esters zijn geen zuren of alcoholen, dus ze gedragen zich niet als zodanig. De smeltende en kookpunten zijn bijvoorbeeld lager dan die met vergelijkbare molecuulgewichten, maar dichter bij waarden als die van de aldehyden en ketonen.
Butaanzuur, cho3Ch2Ch2COOH, heeft een kookpunt van 164º C, terwijl ethylacetaat, ch3Cooch2Ch3, van 77.1e c.
Afgezien van het recente voorbeeld, de kookpunten van 2-methylbutaan3CH (Ch3) Ch2Ch3, Methylacetaat, cho3Cooch3, en 2-butanol, cho3,Ch (oh) ch2Ch3, Ze zijn als volgt: 28, 57 en 99º C. De drie verbindingen hebben molecuulgewichten van 72 en 74 g/mol.
Lage moleculaire pesosesters zijn meestal vluchtig en hebben aangename geuren, en daarom geeft hun inhoud in fruit hen hun familiegeuren. Aan de andere kant, wanneer hun molecuulgewichten hoog zijn, zijn ze kleurloze en geurloze kristallijne vaste stoffen, of afhankelijk van hun structuur, kunnen ze vette kenmerken vertonen.
Oplosbaarheid in water
Carbonzuren en alcoholen zijn meestal oplosbaar in water, tenzij ze een hoog hydrofoob karakter hebben in hun moleculaire structuren. Hetzelfde geldt voor esters. Wanneer r of r 'korte ketens zijn, kan de ester interageren met watermoleculen door dipool-dipolo en krachten van Londense troepen.
Kan u van dienst zijn: chemische verbindingDit komt omdat esters waterstofbrug acceptoren zijn. Als? Voor zijn twee RCOor -zuurstofatomen '. Watermoleculen kunnen waterstofbruggen vormen met een van deze zuurstof. Maar wanneer de R- of R -ketens erg lang zijn, afstoten ze het water in hun omgeving, waardoor het onmogelijk is voor hun ontbinding.
Een duidelijk voorbeeld hiervan gebeurt met triglycerid -esters. Hun zijketens zijn lang en maken oliën en vetten onoplosbaar in het water, tenzij ze in contact zijn met een minder polair oplosmiddel, meer gerelateerd aan deze ketens.
Hydrolysereactie
Esteres kunnen ook reageren met watermoleculen in wat bekend staat als hydrolysereactie. Ze vereisen echter een zure of basisomgeving om het mechanisme van de reactie te bevorderen:
RCoor ' + H2OF RCOOh + R'oH
(Zure helft)
Het watermolecuul wordt toegevoegd aan de carbonylgroep, c = o. Zure hydrolyse is samengevat bij de vervanging van elke R 'van de alcoholische component door een OH uit water. Merk ook op hoe de ester in zijn twee componenten "breekt": carbonzuur, RCOOH en R'OH alcohol.
RCoor ' + Oh- => RcoOF- + R'oH
(Basismedium)
Wanneer hydrolyse wordt uitgevoerd in een basismedium, treedt een onomkeerbare reactie op bekend als bekend als verzeping. Dit is erg in dienst en is de hoeksteen in de uitwerking van ambachtelijke of industriële zeep.
De rcoo- Het is het carboxylaatanion, stabiel, dat elektrostatisch wordt geassocieerd met het overheersende kation in het midden.
Als de gebruikte basis NaOH is, wordt het zout gevormd. Wanneer de ester een triglyceride is, dat per definitie drie R -zijketens heeft, worden drie vetzuurzouten, Rcoone en glycerolalcohol gevormd.
Reductiereactie
Esters zijn sterk geoxideerde verbindingen. Het betekent dat het verschillende covalente bindingen heeft met zuurstof. Door C-O-bindingen te elimineren, treedt een pauze op die uiteindelijk de zuur- en alcoholische componenten scheidt; En nog meer, zuur wordt gereduceerd tot een minder geoxideerde manier, tot een alcohol:
RCoor '=> rCH2Oh + r'oh
Dit is de reductiereactie. Een sterk reductiemiddel is nodig, zoals lithium en aluminiumhydride, lialh4, en van een zuur medium dat elektronenmigratie bevordert. Alcoholen zijn de kleinste vormen, dat wil zeggen die met minder covalente bindingen met zuurstof (slechts één: C-OH).
De twee alcoholen, rch2OH + R'OH, kom uit de twee respectieve ketens van de oorspronkelijke ester RCOor '. Dit is een methode voor synthese van waarde -toegepaste alcoholen uit zijn esters.
Als u bijvoorbeeld een alcohol van een exotische esters wilt produceren, zou dit voor dat doel een goede route zijn.
Transterificatiereactie
Esters kunnen worden omgezet in anderen als ze reageren in zure of basismedia met alcoholen:
RCoor ' + R "Oh RCOOf " + R'oH
Esterstructuur
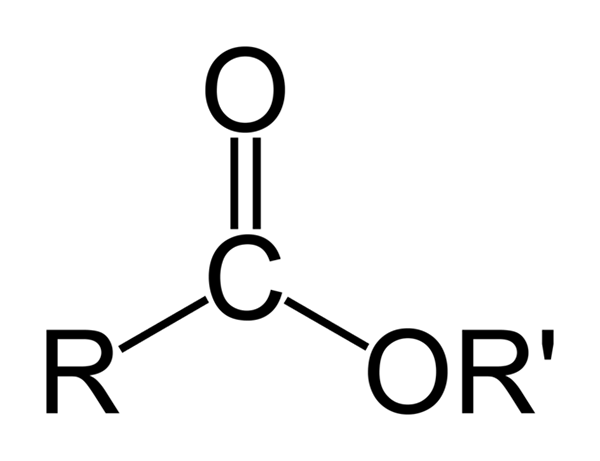 Algemene chemische structuur van organische esters. Bron: Ben Mills via Wikipedia
Algemene chemische structuur van organische esters. Bron: Ben Mills via Wikipedia Het superieure beeld vertegenwoordigt de algemene structuur van alle organische esters. Merk op dat R, de carbonylgroep C = O en of 'een platte driehoek vormen, product van SP -hybridisatie2 van het centrale koolstofatoom. Andere atomen kunnen echter andere geometrieën aannemen en hun structuren zijn afhankelijk van de intrinsieke aard van R of R '.
Kan u van dienst zijn: nitraten: eigenschappen, structuur, nomenclatuur, trainingAls r of r 'eenvoudige alqulicasketens zijn, bijvoorbeeld van het type (kies2))NCh3, Je zult zigzagueada in de ruimte kijken. Dit is het geval van Pentilo Butanoat3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3.
Maar in een van de koolstofatomen van die ketens kon een tak of onverzadiging worden gevonden (C = C, C≡C), die de globale structuur van de ester zou wijzigen. En om deze reden variëren de fysieke eigenschappen, zoals oplosbaarheid en zijn kokende en fusiepunten, met elke verbinding.
Onverzadigde vetten hebben bijvoorbeeld dubbele links in hun R -ketens, die intermoleculaire interacties negatief beïnvloeden. Als gevolg hiervan dalen hun smeltpunten af, totdat ze vloeibaar zijn, of oliën, bij kamertemperatuur.
Waterstofbrug acceptor
Hoewel het beeld van het skelet van de esters meer opvalt, zijn het de R- en R -ketens die verantwoordelijk zijn voor diversiteit in hun structuren.
Een structureel kenmerk van de esters is echter verdiend tot de driehoek: het zijn waterstofbrug acceptoren. Als? Door zuurstof van carbonyl- en alcoxidegroepen (de -or ').
Deze hebben vrije elektronenparen, die gedeeltelijk positieve waterstofatomen van watermoleculen kunnen aantrekken.
Daarom is het een speciaal type dipool-dipool interacties. De watermoleculen naderen de ester (als de r o r 'ketens niet voorkomen en de bruggen worden gevormd c = o-h2Of, of oh2-OF '.
Nomenclatuur van esters
Om een ester op de juiste manier te noemen, is het noodzakelijk. Ook elke mogelijke tak, substituent of onverzadiging.
Zodra dit is gebeurd, wordt de naam van de r 'van de alcoxidegroep -of' het achtervoegsel toegevoegd -I Lo, Terwijl de carboxilo -koor groepsketen R, het achtervoegsel -ATO. Eerst wordt sectie R genoemd, gevolgd door het woord 'van' en vervolgens de naam van de sectie R ''.
Bijvoorbeeld cho3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3 Het heeft vijf koolstofatomen aan de rechterkant, dat wil zeggen, zij zijn degenen die overeenkomen met R '. En aan de linkerkant zijn er vier koolstofatomen (inclusief de carbonylgroep C = O).
Daarom is R 'een Pentil -groep, en r A butane (voor het opnemen van carbonyl en het overwegen van de hoofdketen). Om de naam te geven aan de verbinding, is het voldoende om de overeenkomstige achtervoegsels toe te voegen en ze in de juiste volgorde te noemen: ButaneATO van pentI Lo.
Hoe de volgende verbinding te noemen: CH3Ch2COOC (Ch3))3? De ketting -c (cho3))3 komt overeen met het recto-butyl alquilical substituent. Omdat de linkerkant drie koolstofatomen heeft, is het een "propaan". Zijn naam is dan: propaanATO van tert-butI Lo.
Hoe worden esters gevormd?
Verestering
Er zijn veel routes om ester te synthetiseren, waarvan sommige zelfs nieuw kunnen zijn. Ze komen echter allemaal samen in het feit dat de driehoek van het beeld van de structuur moet worden gevormd, dat wil zeggen de co-o-link. Daarvoor moet het beginnen vanuit een compound die voorheen de carbonylgroep heeft: als carbonzuur.
En wat moet carbonzuur worden gekoppeld? Voor een alcohol, anders zou het niet de alcoholische component hebben die de esters kenmerkt. Carbonzuren vereisen echter warmte en zuurgraad om het reactiemechanisme te laten doorgaan. De volgende chemische vergelijking vertegenwoordigt het bovenstaande:
Kan u van dienst zijn: aluminium hydride (ALH3): structuur, eigenschappen, gebruikRCOOH + R'OH RCoor ' + H2OF
(Zure helft)
Dit staat bekend als verestering.
Vetzuren kunnen bijvoorbeeld versterken met methanol, cho3Oh, om hun zuren te vervangen door methylgroepen, dus deze reactie kan ook worden beschouwd als methylering. Dit is een belangrijke stap bij het bepalen van het vetzuurprofiel van bepaalde oliën of vetten.
Esteres van zure chloriden
Een andere manier om esters te synthetiseren is van acylchloriden, rcocl. In hen, in plaats van een OH -hydroxylgroep te vervangen, wordt de CL -atoom vervangen:
Rcocl + r'OH => rCoor ' + hcl
En in tegenstelling tot de sterificatie van een carbonzuur, wordt water niet vrijgegeven maar zoutzuur.
Andere methoden zijn beschikbaar binnen de wereld van organische chemie, zoals de oxidatie van Baeyer-Villiger, die peroxyzuren (RCOOOH) gebruikt.
Estres gebruikt
 Esteres worden gebruikt voor verschillende dingen, zoals het maken van kaars
Esteres worden gebruikt voor verschillende dingen, zoals het maken van kaars Een van het belangrijkste gebruik van esters zijn:
- In de uitwerkingskaarsen of kaarsen, zoals het superieure imago. Hiertoe worden zeer lange zijketenesters gebruikt.
- Als geneeskunde conserveermiddelen of voedsel. Dit komt door de werking van de parabenen, die niets meer zijn dan esteres van para-hydroxibenzoëzuur. Hoewel ze de kwaliteit van het product behouden, zijn er studies die het positieve effect op het lichaam in twijfel trekken.
- Ze dienen voor de productie van kunstmatige geuren die de geur en smaak van veel fruit of bloemen imiteren. Zodat esters aanwezig zijn in traktaties, ijs, parfums, cosmetica, zeep, shampoos, onder andere commerciële producten die aroma's verdienen of aantrekkelijke smaken.
- Esters kunnen ook een positief farmacologisch effect bieden. Om deze reden heeft de farmaceutische industrie zich toegewijd aan het synthetiseren van esters die zijn afgeleid van zuren die in het lichaam aanwezig zijn om elke mogelijke verbetering van de behandeling van ziekten te evalueren. Aspirine is een van de eenvoudigste voorbeelden van deze esters.
- Vloeibare esters, zoals ethylacetaat, zijn voldoende oplosmiddelen voor bepaalde soorten polymeren, zoals nitrocellulose en een breed scala aan harsen.
Voorbeelden van esters
Sommige extra esters voorbeelden zijn de volgende:
- Butanato de Pentilo, Ch3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3, die ruikt naar albicoque en peren.
- Vinylacetaat, cho3Cooch2= Ch2, waaruit het polyvinylacetaatpolymeer optreedt.
- Isopentilo pentanoato, ch3Ch2Ch2Ch2Cooch2Ch2CH (Ch3))2, die de smaak van appels nabootst.
- Ethylpropanoaat, ch3Ch2Cooch2Ch3.
- Propylmetanoaat, hcooch2Ch2Ch3.
Referenties
- T.W. Graham Solomons, Craight B. Friteuse. Organische chemie. (Tenth Edition, p 797-802, 820) Wiley Plus.
- Carey, f. NAAR. Organic Chemistry (2006) Zesde editie. Mc Graw Hill Editorial-
- Chemistry Libhethexts. Nomenclatuur van ESers. Hersteld van: chem.Librhetxts.borg
- beheerder. (19 september 2015). Esters: zijn chemische aard, eigenschappen en gebruik. Uitgevoerd uit: pure-chemisch.com
- Organische chemie in ons dagelijks leven. (9 maart 2014). Wat zijn het gebruik van esters? Opgehaald uit: Gen2Chemist Assignment.Weebel.com
- Chemici.Net (2018). Voorbeelden van esters. Hersteld van: chemics.netto
- Paz María de Lourdes Cornejo Arteagaa. Hoofdtoepassingen van esters. Genomen uit: uaeh.Edu.mx
- Jim Clark. (Januari 2016). INLEIDING ESTERS. Uitgebracht van: ChemGuide.co.Uk

