Isotone oplossingcomponenten, voorbereiding, voorbeelden
- 1439
- 119
- Dr. Rickey Hudson
A Isotone oplossing Het is er een die dezelfde concentratie opgeloste stof presenteert met betrekking tot een oplossing gescheiden of geïsoleerd door een semipermeabele bug. Met deze barrière kan het oplosmiddel transte, maar niet alle opgeloste deeltjes.
In de fysiologie verwijst deze geïsoleerde oplossing naar intracellulaire vloeistof, dat wil zeggen het interieur van de cellen; Terwijl de semipermeabele barrière overeenkomt met het celmembraan, gevormd door een lipide bilay.
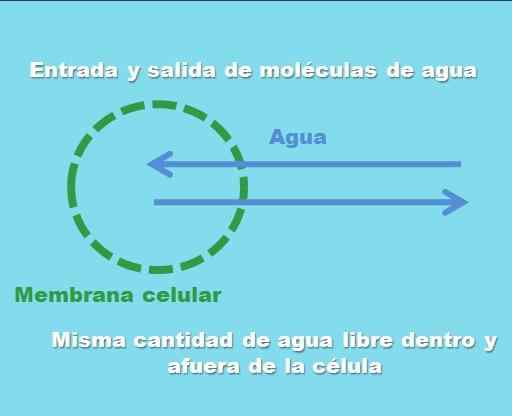
 Interactie van een cel met een isotone oplossing. Bron: Gabriel Bolívar.
Interactie van een cel met een isotone oplossing. Bron: Gabriel Bolívar. Het superieure beeld illustreert wat wordt bedoeld met een isotone oplossing. De "concentratie" van water is hetzelfde binnen en buiten de cel, zodat hun moleculen binnenkomen of door het celmembraan komen met gelijke frequenties. Daarom, als twee watermoleculen de cel binnenkomen, zullen er twee van hen tegelijkertijd naar het extracellulaire medium vertrekken.
Deze toestand, genaamd isotoniciteit, vindt alleen plaats wanneer het waterige medium, binnen en buiten de cel, hetzelfde aantal opgeloste opgeloste vasteeltjes bevat. Aldus zal een oplossing isotoon zijn als de concentratie van zijn opgeloste stoffen vergelijkbaar is met die van het vloeistof- of intracellulaire medium. De 0,9% zoutoplossing is bijvoorbeeld isotoon.
[TOC]
Componenten van isotone oplossingen
Om er een isotone oplossing te zijn, moet het er eerst voor zorgen dat de osmose optreedt in de oplossing of oplosmiddel. Dit is alleen mogelijk als er een semipermeabele barrière aanwezig is, waardoor oplosmiddelmoleculen deze kunnen overbrengen, maar niet die van opgeloste, vooral elektrisch geladen opgeloste stoffen, ionen.
De opgeloste stof kan dus niet worden verspreid van meer geconcentreerde gebieden naar meer verdunde gebieden. In plaats daarvan zullen het de watermoleculen zijn die van de ene plaats naar de andere gaan, de semipermeabele barrière oversteken en de osmose plaatsvinden. In waterige en biologische systemen is deze barrière bij uitstek het celmembraan.
Can You: Competition (Biology): Kenmerken, typen, voorbeeldenMet een semipermeabele barrière en een oplosmiddelmedium, is de aanwezigheid van opgeloste ionen of zouten in beide media ook noodzakelijk: de interne (in de barrière) en de externe (buiten de barrière).
Als de concentratie van deze ionen aan beide zijden hetzelfde is, is er geen overtollig of tekort aan watermoleculen om ze op te lossen. Dat wil zeggen, het aantal watervrije moleculen is hetzelfde en daarom zullen ze de semipermeable barrière nergens overbrengen met het doel om de concentraties van de ionen te matchen.
Voorbereiding
- Voorwaarden en vergelijking
Hoewel een isotone oplossing kan worden bereid met elk oplosmiddel, omdat water het medium van de cellen is, wordt dit beschouwd als de favoriete optie. Het is mogelijk om precies de concentratie van zouten in een specifiek lichaam van het lichaam, of in de bloedbaan te kennen, kan schatten hoeveel zouten het in een bepaald volume moet oplossen.
In organismen van gewervelde dieren wordt geaccepteerd dat de concentratie van de opgeloste plasma gemiddeld ongeveer 300 mosm/l (miliosmolariteit) is, bijna als 300 mmol/l kan interpreteren. Dat wil zeggen, het is een zeer verdunde concentratie. Om de miliosmolariteit te schatten, moet de volgende vergelijking worden toegepast:
Osmolariteit = m · v · g
Voor praktische doeleinden wordt dat aangenomen G, De osmotische coëfficiënt heeft een waarde van 1. Zodat de vergelijking nu is als:
Osmolariteit = m · v
Waar M Het is de molariteit van de opgeloste stof, en v Het aantal deeltjes waarin genoemde opgeloste stof in het water dissocieert. Dan vermenigvuldigen we deze waarde met 1.000 om de miliosmolariteit voor een bepaalde opgeloste stof te verkrijgen.
Kan u van dienst zijn: wat is homoplasie? (Met voorbeelden)Als er meer dan één opgeloste stof is, zal de totale miliosolariteit van de oplossing de som zijn van de duizenden molariteiten voor elke opgeloste stof. Hoe meer opgeloste stof ten opzichte van het interieur van de cellen, hoe minder isotoon de voorbereide oplossing zal zijn.
- Voorbeeld van voorbereiding
Stel dat u een liter isotone oplossing wilt voorbereiden op basis van glucose- en natriumdiácid -fosfaat. Hoeveel zou het wegen van glucose? Neem aan dat 15 gram nah zal worden gebruikt2Po4.
Eerste stap
We moeten eerst de nah osmolariteit bepalen2Po4 het berekenen van zijn molariteit. Om dit te doen, wenden we ons tot zijn molaire massa of molecuulgewicht, 120 g/mol. Omdat we om een liter oplossing worden gevraagd, bepalen we de mollen en zullen we direct molariteit hebben:
Mol (nah2Po4) = 15 g ÷ 120 g/mol
= 0,125 mol
M (NAH2Po4) = 0,125 mol/l
Maar wanneer de nah2Po4 Het lost op in water, geeft een na -kation vrij+ en een anion h2Po4-, vandaar v Het heeft een waarde van 2 in de osmolariteitsvergelijking. We gaan dan verder berekenen voor de nah2Po4:
Osmolariteit = m · v
= 0,125 mol/l · 2
= 0,25 OSM/L
En door het te vermenigvuldigen met 1.000 We hebben de miliosmolariteit van nah2Po4:
0,25 OSM/L · 1.000 = 250 MOSM/L
Tweede stap
Aangezien de totale miliosolariteit van de oplossing gelijk moet zijn aan 300 moSM/L, trekken we af om te weten wat de glucose zou moeten zijn:
MOSM/L (glucose) = moSM/L (totaal) - moSM/L (nah2Po4))
= 300 moSM/L - 250 mob/l
= 50 mozem/l
Omdat glucose niet dissocieert, v Vale 1 en de osmolariteit is gelijk aan zijn molariteit:
M (glucose) = 50 moSM/L ÷ 1.000
= 0,05 mol/l
Omdat het de kies van glucose 180 g/mol is, bepalen we eindelijk hoeveel gram we moeten wegen om het op te lossen in die liter isotone oplossing:
Kan u dienen: Renina: Structuur, productie, secretie, functiesMassa (glucose) = 0,05 mol · 180 g/mol
= 9 g
Daarom deze isotone oplossing van NAH2Po4/glucose bereidt 15 gram nah2Po4 en 9 gram glucose in een liter water.
Voorbeelden van isotone oplossingen
Isotone oplossingen of vloeistoffen veroorzaken geen gradiënt of verandering in de concentratie van ionen in het lichaam, dus hun actie richt zich in wezen op hydraterende patiënten die het ontvangen in geval van bloeding of uitdroging.
Normale zoutoplossing
Een van deze oplossingen is normale zoutoplossing, met een NaCl -concentratie van 0,9%.
Ringer Lactate -oplossing
Andere isotone oplossingen die voor hetzelfde doel worden gebruikt, zijn die van Ringer Lactate, die de zuurgraad vermindert vanwege de buffer- of dempingsamenstelling, en Sorensen's fosfaatoplossingen, die zijn samengesteld uit fosfaten en natriumchloride.
Niet -waterige systemen
Isotoniciteit kan ook worden toegepast op niet -waterige systemen, zoals die waar het oplosmiddel een alcohol is; Zolang er een semipermeabele barrière is die de transparantie van alcoholmoleculen bevordert en de opgeloste deeltjes behoudt.
Referenties
- Van Lehr Spilva, tot. En Muktans, en. (1999). Gids voor farmaceutische specialiteiten in Venezuela. Xxxvª editie. Globale edities.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Elsevier B.V. (2020). ISOTONE OPLOSSING. Opgehaald uit: Scientedirect.com
- Adrienne Brundage. (2020). Isotone oplossing: definitie en voorbeeld. Studie. Hersteld van: studie.com
- Felicitas Merino de la Hoz. (S.F.)). Intraveneuze serotherapie. Universiteit van Cantabria. [PDF]. Hersteld van: ocw.Unicaans.is
- Het farmaceutica en het samengestelde laboratorium. (2020). Oftalmische preparaten: isotone buffers. Hersteld van: Pharmlabs.UNC.Edu

