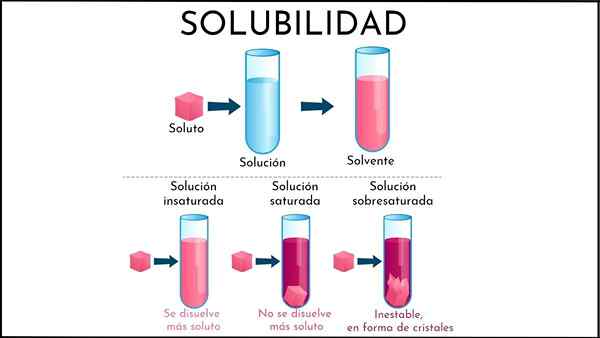
Onverzadigde oplossing
- 3886
- 1182
- Alton D'Amore
 In de onverzadigde oplossing is de oplosmiddel helft nog steeds in staat om meer opgeloste stof op te lossen
In de onverzadigde oplossing is de oplosmiddel helft nog steeds in staat om meer opgeloste stof op te lossen Wat is een onverzadigde oplossing?
A onverzadigde oplossing Het is al die oplossing waarin het oplosmiddelmedium nog steeds in staat is om meer opgeloste stof op te lossen. Dit medium is over het algemeen vloeibaar, hoewel het ook gasvormig kan zijn. Wat de opgeloste stof betreft, is het een conglomeraat van vaste of gasvormige deeltjes.
En hoe zit het met vloeibare opgeloste stoffen? In dat geval is de oplossing homogeen zolang beide vloeistoffen mengbaar zijn. Een voorbeeld hiervan is de toevoeging van ethylalcohol aan het water; De twee vloeistoffen met hun moleculen, cho3Ch2Oh en h2Of ze zijn mengbaar omdat ze waterstofbruggen vormen (kies3Ch2OH OH2)).
Als dicloromethaan echter mengt (kies2Klet2) en water, deze zouden een oplossing vormen met twee fasen: de ene waterige en de andere organische. Dit komt omdat choles van CH2Klet2 en h2Of interactie zeer zwak, dus sommigen glijden over de andere, wat resulteert in twee niet -mengbare vloeistoffen.
Een minimale druppel cho2Klet2 (opgeloste) genoeg om het water te verzadigen (oplosmiddel). Als ze daarentegen een onverzadigde oplossing kunnen vormen, zou een volledig homogene oplossing worden gezien.
Om deze reden kunnen alleen solide en gasvormige opgeloste stoffen onverzadigde oplossingen genereren.
Wat is een onverzadigde oplossing?
In een onverzadigde oplossing interageren oplosmiddelmoleculen met effectiviteit zodat opgeloste moleculen geen andere fase kunnen vormen.
Dit betekent dat oplosmiddel-opgeloste interacties overschrijden, gezien de druk- en temperatuuromstandigheden, opgeloste interacties.
Zodra de opgeloste interacties opgelost zijn, "orkestreren" ze de vorming van een tweede fase. Als het oplosmiddelmedium bijvoorbeeld een vloeistof is en de opgeloste stof, zal de tweede in de eerste oplossen die een homogene oplossing vormt, totdat er een vaste fase verschijnt, wat niets meer is dan de neergelopen opgeloste stof.
Het kan u van dienst zijn: polymethylmetacrylaatDit neerslag is te wijten aan het feit dat de opgeloste moleculen erin slagen te worden gegroepeerd door hun chemische aard, intrinsiek voor hun structuur of links. Wanneer dit gebeurt, wordt gezegd dat de oplossing verzadigd is met opgeloste stof.
Daarom bestaat een onverzadigde opgeloste oplossing uit een vloeibare fase zonder neerslag. Terwijl als de opgeloste stof gasvormig is, dan een onverzadigde oplossing moet vrij zijn van de aanwezigheid van bubbels (die niets meer zijn dan clusters van frisdranken).
Temperatuureffect
De temperatuur heeft direct invloed op de mate van onverzadiging van een oplossing ten opzichte van een opgeloste stof.
Dit kan voornamelijk te wijten zijn aan twee redenen: de verzwakking van opgeloste interacties van opgeloste stof vanwege warmte-effect en de toename van moleculaire trillingen die de opgeloste moleculen helpen verspreiden.
Als een oplosmiddelmedium wordt beschouwd als een compacte ruimte in wiens gaten de opgeloste moleculen zijn gehuisvest, verhoogt de temperatuur dat de moleculen trillen die de grootte van deze gaten verhogen; op een zodanige manier dat de opgeloste stof in andere richtingen kan vinden.
Onoplosbare vaste stoffen
Sommige opgeloste stoffen hebben echter zulke sterke interacties, dat oplosmiddelmoleculen nauwelijks in staat zijn om ze te scheiden.
Wanneer dit zo is, is een minimale concentratie van genoemde opgeloste opgeloste stof voldoende om neer te slaan, en dan is het een onoplosbare vaste stof.
Onoplosbare vaste stoffen, door een tweede vaste fase te vormen die verschilt van de vloeibare fase, genereren weinig onverzadigde oplossingen.
Als bijvoorbeeld 1L van de vloeistof A slechts 1 g B kan oplossen zonder neer te slaan, dan bij het mengen van 1L van A met 0.5 g B zal een onverzadigde oplossing genereren.
Het kan u van dienst zijn: HydrocoloidEvenzo vormt een rang van concentraties die variëren tussen 0 en 1 g van B ook onverzadigde oplossingen. Maar na 1G zal B neerslaan. Wanneer dit gebeurt, gaat de oplossing van onverzadigd naar verzadigd van B.
Als een verzadigde oplossing met 1 wordt voorgelegd aan verwarming.5g B, warmte zal helpen het opslag van het neerslag. Als er echter veel B is neergeslagen, kan de warmte het niet oplossen.
Als dat zo is, zou een temperatuurstijging eenvoudig het oplosmiddel of de vloeistof verdampen.
Voorbeelden van onverzadigde oplossing
De voorbeelden van onverzadigde oplossingen zijn talrijk, omdat ze afhankelijk zijn van het oplosmiddel en de opgeloste stof. Voor dezelfde vloeistof A, en andere opgeloste stoffen C, D, E ... Z, zullen hun oplossingen onverzadigd zijn zolang ze niet neerslaan of een bel vormen (als ze gasvormige opgeloste stoffen zijn).
-De zee kan twee voorbeelden bijdragen. Zeewater is een enorme reddingoplossing. Als u een beetje van dit water plaatst, wordt opgemerkt dat het onverzadigd is in afwezigheid van neergeslagen zout. Naarmate het water echter verdampt, beginnen de opgeloste ionen te worden gegroepeerd, waardoor Saltpeter aan de pot wordt geplakt.
-Een ander voorbeeld is het oplossen van zuurstof in de zeewater. Het molecuul van O2 Frank de diepten van de zee genoeg om mariene fauna te ademen, hoewel het weinig oplosbaar is.
Om deze reden is het gebruikelijk om de zuurstofbellen naar het oppervlak te observeren; waarvan een paar moleculen slagen erin om op te lossen.
Een vergelijkbare situatie treedt op met het koolstofdioxidemolecuul, CO2. In tegenstelling tot O2, De CO2 Het is iets meer oplosbaar omdat het reageert met water om koolzuur te vormen, h2CO3.
Kan u van dienst zijn: materiaalsystemenVerschil met verzadigde oplossing
Samenvatten van de nieuw uitgelegd, wat zijn de verschillen tussen een onverzadigde en verzadigde oplossing? Ten eerste bestaat het visuele aspect: een onverzadigde oplossing bestaat uit een enkele fase. Daarom mag er geen aanwezigheid van vaste (vaste fase) of bel (frisdrankfase) zijn.
Ook kunnen opgeloste concentraties in een onverzadigde oplossing variëren totdat een neerslag of bel is gevormd. Terwijl in verzadigde, bifasische oplossingen (vloeistof-vaste of vloeistof-gasvormige), is de concentratie van opgeloste opgeloste stof constant.
Omdat? Omdat de deeltjes (moleculen of ionen) die het neerslag vormen, een evenwicht vestigen met die die in het oplosmiddel liggen opgelost:
Deeltjes van de neerslag opgeloste deeltjes
Bubbelmoleculen opgelost moleculen
Dit scenario wordt niet overwogen in onverzadigde oplossingen. Wanneer u probeert meer opgeloste opgeloste stof op te lossen in een verzadigde oplossing, beweegt de balans naar links; naar de vorming van meer neerslag of bubbels.
Omdat in onverzadigde oplossingen deze balans (verzadiging) nog niet is vastgesteld (verzadiging) kan meer vast of gas "opslaan".
Rond een algen in de zeebodem is er opgeloste zuurstof, maar wanneer zuurstofbellen uit zijn bladeren worden geboren, betekent dit dat gasverzadiging optreedt; Anders zou bubbels niet worden waargenomen.
Referenties
- Algemene scheikunde. lesmateriaal. Lima: Pontifical Catholic University of Peru. Hersteld van: Korinthe.PUCP.Edu.pe
- Helmestine, Anne Marie, pH.D. (2018). Onverzadigde oplossingsdefinitie. Hersteld van: Thoughtco.com
- Tutorvista (s.F.)). Onverzadigde oplossing. Genomen van: chemie.Tutorvista.com
- Chemistry LibeThexts (s.F.)). Soorten verzadiging. Hersteld van: chem.Librhetxts.borg
- Nadine James. (2018). Onverzadigde oplossing: definitie en voorbeeld. Hersteld van: studie.com

