Hypotone oplossingcomponenten, voorbereiding, voorbeelden
- 1791
- 173
- Cecil Graham
A Hypotone oplossing Het is er een die een concentratie van kleine opgeloste stof presenteert met betrekking tot een oplossing gescheiden of geïsoleerd door een semipermeabele bug. Met deze barrière kan het oplosmiddel worden getranste, water in het geval van biologische systemen, maar niet alle opgeloste deeltjes.
Lichaamsvloeistoffen van intracellulaire en extracellulaire gewervelde dieren hebben een osmolariteit van ongeveer 300 moSM/L. Hoewel wordt geacht dat een hypotone vloeistof een osmolariteit heeft van minder dan 280 moSM/L. Een oplossing van deze osmolariteit is dus hypotonisch in relatie tot het cellulaire medium.
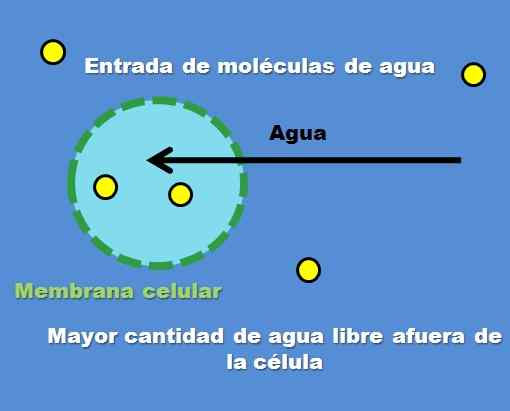
 Interactie van een cel met een hypotone oplossing. Bron: Gabriel Bolívar.
Interactie van een cel met een hypotone oplossing. Bron: Gabriel Bolívar. Een voorbeeld van een hypotone oplossing is 0,45% natriumchloride. Maar hoe gedraagt de cel of compartiment zich voor dit type oplossing? Het superieure beeld beantwoordt deze vraag.
De concentratie van opgeloste deeltjes (gele punten) is hoger in de buitencel. Met minder opgeloste stof rond de cel zijn er meer vrije watermoleculen, dus het wordt weergegeven met een meer intense blauwe kleur in vergelijking met het interieur van de cel.
Water stroomt naar buiten door osmose naar niveauconcentraties. Als gevolg hiervan breidt de cel uit of waaier door water te absorberen dat zijn celmembraan kruist.
[TOC]
Componenten van hypotone oplossingen
Hypotone oplossingen bestaan uit een oplosmiddel dat, tenzij anders aangegeven, uit water bestaat en opgeloste opgeloste opgelost is zoals zouten, suikers, enz., in pure of gemengde vorm. Maar deze oplossing zal geen toniciteit hebben als er geen semipermeabele barrière is, die het celmembraan wordt.
Het kan u van dienst zijn: calciumnitraat (Ca (NO3) 2)Er moeten weinig opgeloste zouten zijn zodat de concentratie klein is, terwijl de "concentratie" van het water hoog is. Met meer vrij water buiten de cel, dat wil zeggen, het is geen oplossen of hydrateren van opgeloste deeltjes, hoe groter de druk op het celmembraan en meer zal het oversteken om de intracellulaire vloeistof te verdunnen.
Bereiding van een hypotone oplossing
Voor de voorbereiding van deze oplossingen wordt hetzelfde protocol gevolgd als de gevolgde voor andere oplossingen. De juiste berekeningen van de massa van de opgeloste stoffen worden gemaakt. Dan worden deze gewogen, oplossen in water en een vlag nemen die wordt gedeeld met het volume dat daarmee overeenkomt.
De hypotone oplossing heeft een lage osmolariteit, meestal minder dan 280 moSM/L. Dus bij het voorbereiden van een hypotone oplossing moeten we uw osmolariteit op een zodanige manier berekenen dat de waarde ervan minder is dan 280 MOSM/L. Osmolariteit kan worden berekend met de volgende vergelijking:
Osmolariteit = m · v · g
Waar M Het is de molariteit van de opgeloste stof, en v Het aantal deeltjes waarin een verbinding in oplossing wordt gedissocieerd. Niet -elektrolytische stoffen dissociëren niet, dus de waarde van V is gelijk aan 1. Dit is het geval van glucose en andere suikers.
Terwijl G is de osmotische coëfficiënt. Dit is een correctiefactor voor de interactie van elektrisch geladen deeltjes (ionen) in oplossing. Voor verdunde oplossingen en niet -dissociate stoffen, bijvoorbeeld glucose, wordt een waarde van G gelijk aan 1 genomen. Er wordt dan gezegd dat molariteit identiek is aan de osmolariteit.
voorbeeld 1
Bereid een natriumchloride -oplossing (NaCl) op bij 0,5 % (P/V) Controleer of het een hypotone oplossing is of niet. NaCl -molecuulgewicht = 58,5 g/mol.
De 0,5 % A gram NaCl -oplossing per liter wordt gedragen:
Kan u van dienst zijn: calciumperoxide (CaO2): eigenschappen, risico's en gebruikNaCl in g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
En we gaan verder met het berekenen van de molariteit en bepalen vervolgens de osmolariteit:
Molariteit = massa (g/l) ÷ molecuulgewicht (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 mol/l
NaCl dissocieert in twee deeltjes: NA+ (kation) en CL- (anion). Dus de waarde van V = 2. Omdat het een verdunde 0,5 %NaCl -oplossing is, kan worden aangenomen dat de waarde van G (osmotische coëfficiënt) 1 is. We hebben dan:
Osmolariteit (NaCl) = molariteit · v · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 MOSM/L
Dit is een hypotonische oplossing, omdat de osmolariteit veel lager is dan de referentie -osmolariteit voor lichaamsvloeistoffen die plasma -osmolariteit is waarvan de waarde ongeveer 300 mode is.
Voorbeeld 2
Bereid een oplossing van een mengsel van calciumchloride (CACL2) bij 0,055 % (P/V) en glucose (C6H12OF6) bij 4 % (P/V). Molecuulgewichten: CACL2 = 111 g/mol en c6H12OF6 = 180 g/mol.
We berekenen de molariteit met de concentraties van de respectieve opgeloste stoffen bij 0,55 g/l en 40 g/l:
Molariteit (cacl2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molariteit (c6H12OF6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
En op dezelfde manier berekenen we de osmolariteiten, wetende dat de klik2 Het dissocieert op drie ionen, twee CL- En een CA2+, en ervan uitgaande dat ze zeer verdunde oplossingen zijn, dus de waarde van v Het is 1. We hebben:
Osmolariteit (CACL2) = 4,95 mm · 3 · 1
= 14,85 mozem/l
Osmolariteit van (c6H12OF6) = 222 mm · 1 · 1
= 222 MOSM/L
Ten slotte wordt de totale osmolariteit van de oplossing de som van individuele osmolariteiten; dat wil zeggen van die van NaCl en Glucose. Dit is daarom:
Kan u van dienst zijn: refractaire materialenTotale osmolariteit van de oplossing = cacl osmolariteit2 + osmolariteit c6H12OF6
= 222 MOSM/L + 14.85 MOSM/L
= 236,85 mozem/l
De oplossing van het mengsel van calcium- en glucosechloride is hypotonisch, omdat de osmolariteit (236,85 moSM/L) veel minder is dan de plasma -osmolariteit (300 moSM/L), die als referentie wordt genomen.
Voorbeelden van hypotone oplossingen
Natriumchloride -oplossing
0,45 % natriumchloride -oplossing wordt intraveneus toegediend aan patiënten met diabetische ketose die uitdroging ontwikkelen in interstitiële en intracellulaire compartimenten. Water stroomt van plasma naar die compartimenten.
Ringer Lactate -oplossing
Ringer Lactate -oplossing nr. 19 is een ander voorbeeld van een hypotone oplossing. De samenstelling is 0,6 g natriumchloride, 0,03 g kaliumchloride, 0,02 g calciumchloride, 0,31 g natriumlactaat en 100 ml gedestilleerd water. Het is een oplossing die wordt gebruikt voor het rehydratatie van de patiënt en is enigszins hypotonisch (274 MOSM/L).
Referenties
- Van Lehr Spilva, tot. En Muktans, en. (1999). Gids voor farmaceutische specialiteiten in Venezuela. Xxxvª editie. Globale edities.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Wikipedia. (2020). Toniciteit. Opgehaald uit: in.Wikipedia.borg
- Union Media LLC. (2020). Isotone, hypotone en hypertone oplossingen. Opgehaald uit: UnionTestPrep.com
- Lodish H, Berk A, Zipursky SL, et al. (2000). Sectie 15.8osmose, waterkanalen en de regulatie van celvolume. NCBI boekenplank. Hersteld van: ncbi.NLM.NIH.Gov
- John Brennan. (13 maart 2018). Hoe u isotoniciteit kunt berekenen. Hersteld van: wetenschap.com

