Methylsalicylaat
- 2371
- 485
- Alton D'Amore
Wat is methylsalicylaat?
Hij methylsalicylaat Het is een chemische stof, van organische aard, beschouwd als de verbinding met een grotere toxiciteit bij de bekende salicyaten, ondanks zijn kleurloze en aangename geur met een lichte zoete aanraking. Deze soort is beter bekend onder de naam Galleria Oil. De formule is c8H8OF3.
Het bevindt zich in een vloeibare toestand in standaardtemperatuur- en drukomstandigheden (25 ° C en 1 atm), met een organische ester die van nature afkomstig is van een breed scala aan planten. Uit de observatie en studie van de productie ervan in de natuur, was het mogelijk om over te gaan tot de synthese van methylsalicylaat.
Deze synthese werd uitgevoerd door middel van een chemische reactie tussen de ester uit het salicylzuur en de combinatie met methanol. Op deze manier maakt deze verbinding deel uit van de salie, witte wijn en fruit zoals pruim en appel, onder andere op natuurlijke wijze gevonden.
Synthetisch, methylsalicylaat wordt gebruikt bij de productie van aromatiseringsmiddelen, evenals in bepaalde maaltijden en drankjes.
Chemische structuur
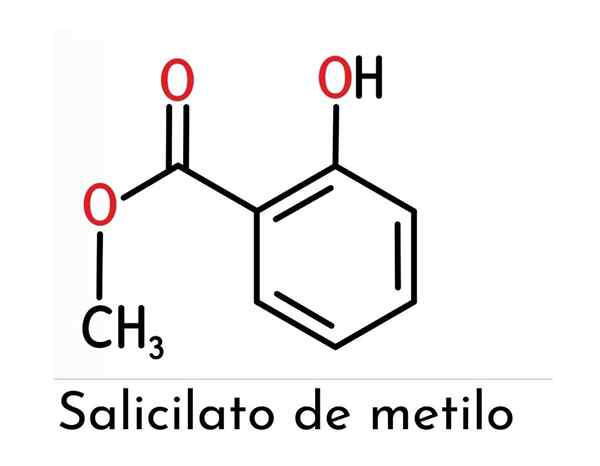
De chemische structuur van methylsalicylaat wordt gevormd door twee hoofdfunctionele groepen (een ester en een fenol die hieraan is bevestigd), zoals weergegeven in het superieure beeld.
Opgemerkt wordt dat het wordt gevormd door een bentnische ring (die een directe invloed op de reactiviteit en stabiliteit van de verbinding vertegenwoordigt), van het salicylzuur waaruit het is afgeleid.
Om ze afzonderlijk te noemen, kan worden gezegd dat ze verenigd zijn in een orthopositie (1.2) een hydroxylgroep en een methylester voor de bovengenoemde ring.
Kan u van dienst zijn: Tertiaire alcohol: structuur, eigenschappen, voorbeeldenDus, aangezien de OH -groep is gekoppeld aan de benzeenring, wordt een fenol gevormd, maar de groep die de grootste "hiërarchie" in dit molecuul heeft, is de ester, die een bepaalde structuur geeft aan deze verbinding en daarom een vrij specifieke kenmerken.
De chemische naam ervan wordt dus gepresenteerd als het 2-hydroxybenzoaat van methyl, verleend door de IUPAC, hoewel minder vaak gebruikt bij het verwijzen naar deze verbinding.
Eigenschappen van methylsalicylaat
- Het is een chemische soort die behoort tot de groep salicyaten, die producten van natuurlijke oorsprong zijn van het metabolisme van sommige plantenorganismen.
- Er is kennis van de therapeutische eigenschappen van salicyaten in medische behandelingen.
- Deze verbinding is aanwezig in bepaalde drankjes zoals witte wijn, thee, salie en bepaalde fruit zoals papaja of kers.
- Het wordt natuurlijk gevonden in de bladeren van een groot aantal planten, vooral in bepaalde families.
- Het behoort tot de groep organische esters die in het laboratorium kunnen worden gesynthetiseerd.
- Het wordt verkregen in vloeibare toestand, waarvan de dichtheid ongeveer 1,174 g/ml is in standaarddruk- en temperatuuromstandigheden (1 atm en 25 ° C).
- Het vormt een kleurloze, geelachtige of roodachtige vloeibare fase, beschouwd als in water oplosbaar (wat een anorganisch oplosmiddel is) en in andere organische oplosmiddelen.
- Het kookpunt is ongeveer 222 ° C, wat zijn thermische ontleding manifesteert rond 340 tot 350 ° C.
- Het presenteert meerdere toepassingen, variërend van aromatiseringsagent in de snoepindustrie tot analgetische en andere producten in de farmaceutische industrie.
Kan u van dienst zijn: natriumazide (nan3): structuur, eigenschappen, gebruik, risico's- De moleculaire formule wordt weergegeven als C8H8OF3 En het heeft een molaire massa van 152,15 g/mol.
Gebruik/toepassingen
Vanwege de structurele kenmerken, een methylester uit salicylzuur, heeft methylsalicylaat een groot aantal toepassingen in verschillende gebieden.
Een van de belangrijkste toepassingen (en de bekendste) van deze stof is die van aromatiseringsagent in verschillende producten: van de cosmetische industrie als geur voor de voedingsindustrie als smaakstoffen in snoep (onder andere kauwrubber, snoepjes, ijs, ijs).
Het wordt ook gebruikt in de cosmetische industrie als verwarmingsmiddel en voor spiermassages in sporttoepassingen. In het laatste geval fungeert het als een rubefactory; dat wil zeggen, het veroorzaakt de oppervlakte roodheid van de huid en de membranen van slijmvliezen wanneer deze hiermee in contact komt.
Op dezelfde manier wordt het gebruikt in crème voor actueel gebruik, vanwege zijn analgetische en ontstekingsremmende eigenschappen in behandelingen voor reumatische aandoeningen.
Een andere van de toepassingen omvat het vloeibare gebruik in aromatherapiesessies, vanwege de essentiële olie -eigenschappen.
Naast het gebruik ervan als een middel voor bescherming tegen ultraviolette straling in zonnebrandcrème, worden de eigenschappen voor het licht voor technologische toepassingen onderzocht, zoals de productie van laservralen of het creëren van gevoelige soorten om informatie in de moleculen op te slaan in de moleculen in de moleculen in de moleculen in de moleculen.
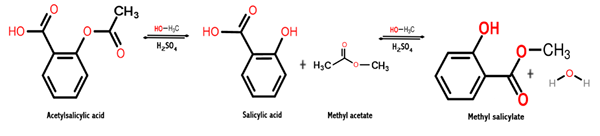
Synthese van methylsalicylaat
Ten eerste moet worden vermeld dat methylsalicylaat op natuurlijke wijze kan worden verkregen door de destillatie van de takken van bepaalde planten, zoals die van de Gaulteria (Guusheria Procumbens) of zoete berken (Langzame betula)).
Het kan u van dienst zijn: geen metalen: geschiedenis, eigenschappen, groepen, gebruikDeze stof werd in 1843 voor het eerst geëxtraheerd en geïsoleerd dankzij de wetenschapper van de Franse afkomst genaamd Auguste Cahours; Van Gailteria wordt het momenteel verkregen door synthese van laboratoria en zelfs commercieel.
De reactie die wordt gegeven om deze chemische verbinding te verkrijgen, is een proces dat verestering wordt genoemd, waarbij een ester wordt verkregen door reactie tussen een alcohol en een carbonzuur. In dit geval komt het voor tussen methanol en salicylzuur, zoals hieronder getoond:
Ch3OH + C7H6OF3 → c8H8OF3 + H2OF
Opgemerkt moet worden dat het deel van het salicylzuurmolecuul dat is versterkend met de hydroxyl (OH) alcohol.
Dus wat er gebeurt tussen deze twee chemische soorten is een condensatiereactie, omdat het watermolecuul tussen de reactanten wordt verwijderd, terwijl de andere reagerende soorten gecondenseerd zijn om het methylsalicylaat te verkrijgen.
Het volgende beeld toont de synthese van methylsalicylaat uit salicylzuur, waar twee opeenvolgende reacties worden getoond.