Haloid verkoopeigenschappen, nomenclatuur, hoe worden ze gevormd, voorbeelden

- 2354
- 645
- Glen Armstrong
De haloïde zouten Het zijn binaire verbindingen gevormd door een metaal en een niet -metaal, zonder enig ander element. Deze zouten worden gevormd door de neutralisatiereactie tussen een hydratatiezuur met een basis. Bijvoorbeeld: de reactie tussen zoutzuur (HCl) met natriumhydroxide (NaOH) om natriumchloride (NaCl) te vormen.
Haloidale zouten worden ook gevormd door de reactie van een hydrie met een metaal. Bijvoorbeeld: de magnesiumreactie met zoutzuur om magnesiumchloride te vormen (mgcl2)). Zoals te zien, zijn chloriden de meest representatieve haloïde zouten. Ze zijn echter niet de enige.
 Halita, natriumchloride in zijn natuurlijke toestand, is het belangrijkste voorbeeld van een haloïde zout. Bron: http: // gl.Wikipedia.org/w/index.PHP?Titel = Gebruiker: Shinichi / Public Domain
Halita, natriumchloride in zijn natuurlijke toestand, is het belangrijkste voorbeeld van een haloïde zout. Bron: http: // gl.Wikipedia.org/w/index.PHP?Titel = Gebruiker: Shinichi / Public Domain Haloïde zouten begrijpen volgens sommige definities de verbindingen die ze in hun halogeenstructuur bevatten; Dat wil zeggen: fluor, chloor, broom en jodium, dus ze worden als synoniem beschouwd met halogeniden of halogenuros.
Evenzo worden binnen de haloïde zouten opgenomen, door sommige auteurs, verbindingen gevormd door de vereniging van een metaal met een element dat zijn negatieve valentie gebruikt, waaronder: carbiden, nitriden, fosfuros, sulfiden, seleniuros, arseniuros, enz. Deze tellen ook als haloïde zouten wanneer ze alleen uit twee elementen bestaan.
[TOC]
Haloid verkoopeigenschappen
Haloïde zouten zijn een groep verbindingen waarvan de eigenschappen moeilijk te vestigen zijn.
Sterke ionische links
Over het algemeen bestaan ze uit vaste stoffen met sterke ionische bindingen tussen ionen van twee elementen: m+X-, waar m+ komt overeen met het metalen kation en x- het anion afgeleid van niet -metaal.
Hoge smeltpunten, koken en sublimatie
Ze hebben meestal zeer hoge fusie-, kook- en sublimatiepunten, precies vanwege de kracht van zijn kristallijne structuur.
Het kan u van dienst zijn: DAPI (4 ', 6-diamidino-2-fenylindol): kenmerken, fundering, gebruikElektriciteits geleiding
In vaste toestand zijn ze slechte geleiders van elektriciteit, maar in waterige oplossing wanneer ioniseren, of wanneer ze fuseren, worden goede bestuurders.
Verschijning
Het zijn kristallijne vaste stoffen die wanneer gefragmenteerde poedervorm een witte kleur kan worden. Veel haloïde zouten kunnen echter een andere kleur hebben. Nikkelchloride is bijvoorbeeld groen, terwijl ijzerchloride een oscillerende kleuring heeft tussen groen en rood.
Oplosbaarheid
De meerderheid van Haluros -zouten zijn oplosbaar in water, met uitzondering van zilver, lood (II) en kwikhalogeniden (i).
Geur
Omdat het geen vluchtige verbindingen zijn, presenteren haloïde zouten geen sterke geuren. Vanwege hun compositie kunnen ze ook van zure, zoute, bittere of zoete smaken zijn.
Nomenclatuur
De haloïde zouten worden genoemd door de naam van het anion met het achtervoegsel te plaatsen oeros, gevolgd door de naam van het metaal direct, voorafgegaan door de conjunctie van. In het geval dat het metaal meer dan één valentie heeft, wordt het metaal geplaatst bij het achtervoegsel beer of ico, Afhankelijk van zijn Valencia.
De naam van het metaal kan ook worden geplaatst zonder achtervoegsel en met het aantal oxidatie tussen haakjes.
Bijvoorbeeld: ijzerchloride (iii) of ijzerchloride, fecl3.
Hoe worden haloïde zouten gevormd?
Haloïde zouten worden voornamelijk gevormd door drie reacties: neutralisatie, zure reactie met een metaal en de reactie van een metaal met een metaal of een niet -metaal werking met een negatieve valentie.
Neutralisatie-reactie
Het is de reactie van een zuur met een basis, die zout en een watermolecuul produceert. Bijvoorbeeld:
HCl +NaOH → NaCl +H2OF
Dit voorbeeld werd aan de prins genoemd.
Reactie van een zuur met een metaal
Een sterk zuur kan reageren met een metaal, wat een zout en de afgifte van waterstof ontstaat (h2)). Bijvoorbeeld: zoutzuur reageert met zink (Zn) om zinkchloride te vormen (ZnCl2):
Kan u van dienst zijn: analytische chemieZn +HCl → ZnCl2 + H2
Combinatie van een metaal met een metaal of een niet -metaal
Deze haloïde zouten zijn het gevolg van de combinatie van een metaal met een metaal of een niet -metaal uit halogenen. Bijvoorbeeld: aluminium fosfuro combineert fosfor met Valencia -3, met aluminium met Valencia +3. Nu is deze "combinatie" te wijten aan specifieke productiereacties voor elk zout.
Gebruik/toepassingen
Metalen halogenuros
Metalen halogenuros worden gebruikt in lampen met hoge intensiteit, zoals moderne lampen. Ze worden ook gebruikt in kassen of regenklimaten als aanvulling op natuurlijk licht. Zilveren halogeniden worden gebruikt in films en fotografische papieren.
Calciumchloride
 Uiterlijk van calciumchloride
Uiterlijk van calciumchloride Calciumchloride wordt gebruikt als calciumbron bij afvalwaterbehandeling. Het wordt ook gebruikt als calciumbron door zijn elektrolyse. Het wordt gebruikt bij de behandeling van hartartmieën en in gevallen van ernstige hypocalciëmie.
IJzerchloride
IJzerchloride wordt gebruikt bij afvalwaterbehandeling en waterzuivering. Het wordt ook gebruikt om koper op te nemen of te kiezen voor koper en in te grijpen als een katalysator in het syntheseproces van vinylchloride.
Chloride en kaliumbromide
Kaliumchloride wordt gebruikt als meststof en bij de behandeling van hypokaliëmie of hypokaliëmie. Kaliumbromide werd daarentegen gebruikt als anticonvulsief en wordt momenteel gebruikt in de farmaceutische industrie en als dressing.
Chloride en natriumsulfide
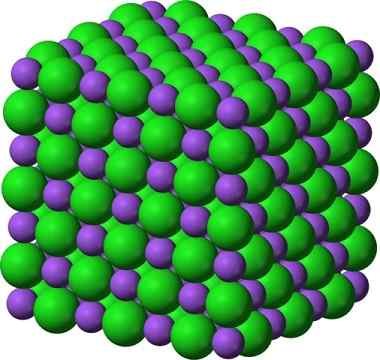
 De kristallijne structuur van natriumchloride, NaCl, een typische ionische verbinding. De __ paarse bollen vertegenwoordigen natriumkationen, Na +, en de __ groene bollen vertegenwoordigen Ancies chloride, Cl -.
De kristallijne structuur van natriumchloride, NaCl, een typische ionische verbinding. De __ paarse bollen vertegenwoordigen natriumkationen, Na +, en de __ groene bollen vertegenwoordigen Ancies chloride, Cl -. Natriumchloride wordt gebruikt als een voedselsmaak, bij het behoud van vlees, als een antisepticum, bij ernstige hyponatriëmie, enz. Natriumsulfide wordt gebruikt in kernreactoren bij de productie van zwaar water, bij de eliminatie van huidharen en bij de vervaardiging van rubbers, kleurstoffen en schilderijen.
Kan u van dienst zijn: aluminiumoxide: structuur, eigenschappen, gebruik, nomenclatuurFosfuros en nituros
Aluminium fosfuro wordt gebruikt als halfgeleider met brede band en als een insecticide. Ondertussen wordt Gallium Nitruro gebruikt als halfgeleider.
Voorbeelden van haloïde zouten
Afgezien van de voorbeelden die in de vorige sectie worden genoemd, zijn andere haloïde zouten met hun respectieve formules en namen:
-NaCl: natriumchloride
-KCL: kaliumchloride
-Splitsen2: Calciumchloride
-Mgcl2: Magnesium chloride
-CSCL: Cesiumchloride
-Bacl2: Bariumchloride
-Fecl2: Ferro chloride
-Fecl3: IJzerchloride
-Nicl2: Nikkelchlorure
-CUCL: koperchloride
-CUCL2: Kupric chloride
-AGCL: zilveren chloride
-Zncl2: Zinkchloride
-Cdcl2: Cadmiumchloride
-Hgcl2: Mercuric chloride
-Alcl3: Aluminiumchloride
-NABR: Natriumbromide
-KBR: kaliumbromide
-CSBR: cesiumbromide
-CDBR: Cadmium Bromide
-Mgbr2: Magnesiumbromide
-Srbr2: Strontium bromide (ii)
-Ki: kalium yoduro
-NAI: Natriumjodide
-CSI: Cesium Yoduro
-Ali3: Aluminium jodide
-BBP2: Loodjodide (ii)
-NAF: Natriumfluoride
-LIF: Lithium Fluoride
-Café2: Calciumfluoride
-PTF2: Platinum fluoride (ii)
-NAS2: Natriumsulfide
-Li4C: Lithium Carbide
-Mg2C: Magnesiumcarbide
-ALP: Aluminium fosfuro
-Ja3N4: Silicium nitruro
-Tin: Titanium Nitruro
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (vierde druk). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Scheikunde. (8e ed.)). Cengage leren.
- Julián Pérez Porto en María Merino. (2016). Definitie van haloïde zouten. Definitie.van. Hersteld van: definitie.van
- James P. Bog. (5 juni 2019). Halide -ins. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Wikipedia. (2020). Gehalide. Opgehaald uit: in.Wikipedia.borg
- « Peroxiden -eigenschappen, nomenclatuur, gebruik, voorbeelden
- Thermohigometer -kenmerken, functies, onderdelen, gebruik »

